Акерлеф
Cтраница 1
Акерлеф исследовал Но, Аг [ 65а ], диацетоновый спирт [ 65б ]; Глесстон и Паунд [ 65в ], Глесстон, Даймонд и Джонс [ 65г ] исследовали уксусноэтиловый эфир. [1]
Акерлеф и Киджелс [ Юл ] применили аналитический метод, дающий возможность избежать последовательных приближений, но требующий представления Е в виде функции от m с помощью метода наименьших квадратов. [2]
Акерлеф исследовал Не, Аг [ 65а ], диацетоновый спирт [ 65б ]: Глесстон и Паунд [ 65в ], Глесстон, Даймонд и Джонс [ 65г ] исследовали уксусноэтиловый эфир. [3]
Акерлефом, основан на предположении, что для смешанного раствора применимо правило Хар-неда. [4]
Результаты Акерлефа для чистой воды помещены в таблице для сравнения. [5]
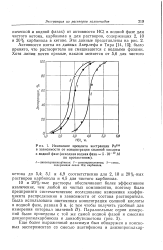 |
Изменение процента экстракции Ра233 в зависимости от концентрации соляной кислоты. [6] |
Активности взяты из данных Акерлефа и Тира [14, 15]; было принято, что растворители не смешиваются с водными фазами. [7]
Однако это правило ( правило Акерлефа и Томаса) справедливо в ограниченном числе случаев ( в области высоких концентраций), а в интервале т 0 5 практически неприменимо ( см. [71], стр. [8]
Харнед и Хеккер [ 2а ] - от 0 05 до 2М, Акерлеф и Кнджелс [ 261-от. [9]
Для подсчета константы равновесия мы воспользовались данными Лукаса [8], Харнеда [9] и Харнеда и Акерлефа [10], определивших коэффициенты активностей хлористого кальция на основании измерений электродвижущих сил, а также коэффициентами активности хлористого марганца, вычисленными Розенфельдом [ и ] по понижению температуры замерзания растворов. К сожалению, эти данные распространяются лишь на область до трехмоляльной концентрации хлористого кальция и до одномоляльной для хлористого марганца. [10]
К тому же типу примитивных зависимостей, представляющих, в отличие от правила У-С, результат упрощения заведомо более сложных зависимостей, вытекающих из опытных данных, относятся правило Акерлефа [ 33, стр. Как известно, правило Харнеда предполагает линейную зависимость Igy одного электролита от концентрации другого электролита при постоянной общей моляльности смешанного раствора. [11]
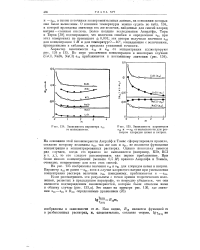 |
Зависимость параметра а12 от моляльности.| Зависимость параметров а12 и - а21 от моляльности для растворов хлоридов цезия и натрия. [12] |
О влиянии температуры можно судить по табл. 104, в которой приведены значения тех же величин, найденные для смесей хлорид натрия - соляная кислота. Более поздние исследования Акерлефа, Тира и Тарка [38] подтверждают, что величина ошибки в определении а21 при этих измерениях не превышает 0 001; эти авторы получили значения а12 для концентрации 1 М и для температур 0 - 40, совпадающие с величинами, приведенными в таблице, в пределах указанной точности. [13]
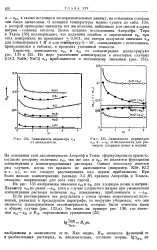 |
Зависимость параметра 12 от моляльности.| Зависимость параметров aia и - а21 от моляльности для растворов хлоридов цезия и натрия. [14] |
О влиянии температуры можно судить по табл. 104, в которой приведены значения тех же величин, найденные для смесей хлорид натрия - соляная кислота. Более поздние исследования Акерлефа, Тира и - Тарка [38] подтверждают, что величина ошибки в определении а21 при этих измерениях не превышает 0 001; эти авторы получили значения а12 для концентрации 1 М и для температур 0 - 40, совпадающие с величинами, приведенными в таблице, в пределах указанной точности. [15]
Страницы: 1 2