Активность - соляная кислота
Cтраница 2
Бее величины в правой части этого уравнения известны, поскольку У TjiYci т С - коэффициент активности соляной кислоты при нулевой концентрации в растворах хлористого натрия ( табл. 161), был определен. [16]
Далее, произведение / н и / сг равно / нС1, где / НС1 - средний коэффициент активности соляной кислоты. [17]
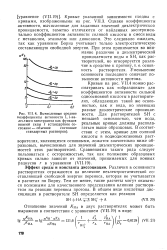 |
Вычисленные средние коэффициенты активности I, 1-ва-леьтного электролита как функция ионной силы / ( стандартное со. [18] |
Кривые указанной зависимости сходны с кривыми, изображенными на рис. VII.3. Однако коэффициенты активности, вычисленные для заданных значений диэлектрической проницаемости, заметно отличаются от найденных экспериментально коэффициентов активности соляной кислоты в смеси воды с метанолом, этанолом или диоксаном. Это следовало ожидать, так как уравнение Борна учитывает только электростатическую составляющую свободной энергии. Уменьшение основности последнего означает повышение активности протона. [19]
Температура пласта играет немаловажную роль в процессе кислотной обработки. Так, активность соляной кислоты ( в том числе коррозионная) резко возрастает в диапазоне температур 20 - 150 С. В связи с этим при проведении кислотных обработок в скважинах с высокой температурой необходимо предусматривать меры уменьшения коррозионной активности кислоты введением соответствующих ингибиторов или снижением температуры в призабойной зоне. [20]
При использовании ( 3, р - дихлордиэтилового эфира ( растворителя с более низкой диэлектрической проницаемостью) повышение экс-трагируемости при малых концентрациях протактиния менее заметно, однако оно легко измеримо. В этих примерах зависимость коэффициента распределения от активности соляной кислоты, по-видимому, одинакова для обеих концентраций протактиния. Это подтверждает то, что введение сильной кислоты, такой, как хлорная или трихлоруксусная, сильно понижает повышенную экстракцию, наблюдаемую для малых концентраций, за счет влияния общего ионного состава в органической фазе. [21]
Так называемый эффект хлорида лития стал понятен, как только установили, что в концентрированных растворах эта соль обладает очень высоким коэффициентом активности. Аномальные результаты приписываются соляной кислоте, так как при высоких концентрациях коэффициенты активности соляной кислоты и хлорида лития очень близки. Остается неясным вопрос о том, почему сорбция металлов из растворов в соляной кислоте ненамного больше. По-видимому, причина этого кроется в ассоциации водорода и хлорид-ионов с образованием соляной кислоты. [22]
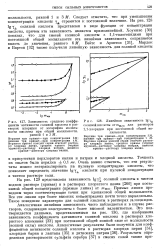 |
Зависимость среднего коэффициента активности соляной кислоты в растворах хлоридов от логарифма моляльности кислоты при общей моляльности. [23] |
Аналогичная линейная зависимость часто наблюдается и в случае растворов, содержащих электролиты с более высокой валентностью. Это подтверждается данными, представленными на рис. 130, где изображена зависимость коэффициента активности соляной кислоты в растворах хлористого алюминия [33] при постоянной общей ионной силе от моляльности ( ионной силы) кислоты. [24]
Эти данные свидетельствуют о том, что во многих случаях коэффициент активности больше в неводных средах, чем в водных. Сделанное заключение находит подтверждение также при оценке влияния органического растворителя ( эффект среды) на коэффициент активности соляной кислоты и других электролитов. На рис. VII.3 представлен средний коэффициент активности у соляной кислоты в воде и пяти неводных растворителях как функция моляльности кислоты. [25]
Для определения p / Ci или рАГ2 готовится раствор, содержащий строго определенные количества нейтральной аминокислоты с, сильной кислоты а или сильного основания Ь, и с помощью водородного электрода любого вида определяют рН раствора. Значения сн или CQH - выводятся из рН, причем коэффициент активности водородных или гидроксильных ионов принимается равным среднему коэффициенту активности соляной кислоты или едкого натра при данной ионной силе раствора. В интервале рН4 - 10 в уравнениях ( 7) и ( 8) можно пренебречь соответственно членами CH и с0н -, если только раствор не слишком разбавлен. [26]
Давление является тормозящим фактором в процессе кислотной обработки. Оно замедляет реакцию и, таким образом, способствует проникновению кислоты в активном состоянии в глубь пласта. Повышение температуры увеличивает активность соляной кислоты в отношении карбонатных пород. Кроме того, высокая температура способствует очищению поверхности ствола скважин от парафино-смолистых отложений, препятствующих взаимодействию кислоты с породами пласта. [27]
В нашем случае нужно знать величины средних коэффициентов активности НСЮ и HN03 в указанных выше тройных системах. Эта закономерность была проверена авторами для коэффициентов активности соляной кислоты в системе HClO - HCl-HjO и получила подтверадение в настоящей работе для хлорной и азотной кислот в исследованных растворах. [28]
Если, однако, в качестве макроэлектролита используется соляная кислота, положение существенным образом изменяется. Кривые, выражающие зависимость D от концентрации соляной кислоты, начинаются так же, как и соответствующие кривые для хлорида лития. Таким образом, кривая для соляной кислоты весьма необычна: она пересекает все другие кривые, и ее форму нельзя объяснить только изменением коэффициентов активности соляной кислоты в фазе раствора, поскольку они мало отличаются от коэффициентов активности хлорида лития. Как мы увидим ниже, эта особенность присуща не только соляной кислоте, но и другим кислотам, и поэтому ее можно назвать кислотным эффектом. Причины кислотного эффекта должны состоять в каких-то изменениях фазы ионита. [29]
Страницы: 1 2