Активность - ионные пары
Cтраница 1
Активность ионных пар в органической фазе резко падает с увеличением концентрации, что связано с обратимым образованием агрегатов ионных пар. Этот процесс может изменять кинетику реакции. [1]
При этом уменьшение активностей ионных пар происходит симбатно с понижением их констант диссоциации. [2]
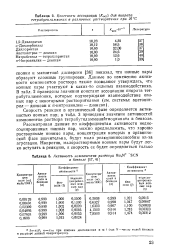 |
Константы ассоциации ( / Cacc для пикрата тетрабутиламмония в различных растворителях при 25 С.| Активность компонентов раствора ВщМ4 - SCN в бензоле. [3] |
Рассматривая данные по коэффициентам активности недис-социированных ионных пар, можно предположить, что хорошо растворимые ионные пары, концентрация которых в органической фазе значительна, будут мало реакционноспособны из-за агрегации. [4]
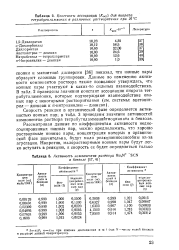 |
Константы ассоциации ( / Cacc для пикрата тетрабутиламмония в различных растворителях при 25 С.| Активность компонентов раствора ВщМ4 - SCN в бензоле. [5] |
Скорость реакции в органической фазе определяется активностью ионных пар; в табл. 3 приведены значения активностей компонентов раствора тетрабутиламмонийтиоцианата в бензоле. [6]
В этой системе уже в случае Na активность ионных пар превышает активность свободных ионов, о чем свидетельствует повышение скорости реакции при добавках NaBPlu, подавляющего диссоциацию соли. [7]
Поскольку энергия взаимодействия ионов в паре падает от Li к Cs, рост активности ионных пар в обратном направлении может быть обусловлен только координацией и сильной дополнительной активацией мономера противоионом, усиливающейся с уменьшением его радиуса. Такая активация характерна для низкомолекулярных реакций эпоксидов, где она является причиной часто наблюдаемой тримолекулярной кинетики в связи с тем, что осуществляется двумя различными молекулами. [8]
Хотя константы скорости роста для Cs и Bu4N являются результатом оценки, они позволяют выявить характерное возрастание активности ионных пар с ростом радиуса катиона. [9]
Подобные взаимодействия в виниловых полимерах с периферическими донорными группами также могут приводить к частичной абстракции катиона и повышению активности ионных пар. [10]
При рассмотрении кинетических данных по полимеризации окиси этилена ( табл. 7) нельзя не заметить, что активность свободных ионов не так уж сильно превышает активность ионных пар: максимальное значение отношения kp - / kp составляет 100 в гексаметилфосфортриамиде. Хотя эти данные получены для сильносольватирующих растворителей, которые, в принципе, способны сольватировать и анион, такая же ситуация наблюдается в эфирных средах; оценка возможного ионного вклада в константу роста была приведена выше. [11]
Из анализа приведенных данных видно, что в бензольных растворах, по-видимому, можно не учитывать диссоциацию ионных пар, перешедших в органическую фазу, и использовать для расчета концентрации и активности недиссоциированных ионных пар. [12]
Так, в результате ряда работ последних лет [127, 135-140] на основании кинетических и кондуктометрических исследований полимеризации стирола в присутствии щелочных металлов в ТГФ было показано, что определяющую роль в этом процессе играют свободные карбанионы, активность которых при 25 С примерно на 3 порядка превышает активность ионных пар. [13]
Полимеризация метилметакрилата представляет для нас интерес еще в одном отношении. Низкие значения констант диссоциации ( см. табл. 16) указывают на сильное дополнительное взаимодействие катиона с таким донорным заместителем, как сложноэфирная группа полимера. Такой автосольватацией авторы [92] объясняют, в частности, слабое влияние катиона на активность ионных пар живого полиметилметакрилата, где переход от Na к Cs изменяет k - от 60 до 80 М 1 сек 1, тогда как в случае живого полистирола такая замена повышает fep на два порядка. [14]
Для пяла ионов щелочных металлов небольшого размера ( рис. 80) эти соотношения сложнее, что находит свое выражение в минимуме при поглощении калия. Здесь налагаются три эффекта. Наряду с изменением давления набухания, которое имеет место благодаря сшивке обменника, проявляются различия в объемах ионов, так как отдельные гидратированные ионы различным образом реагируют на изменение давления набухания вследствие различной прочности связи их гидратной воды. Наконец, имеет место также относительное изменение во взаимном соотношении коэффициентов активности соответствующих ионных пар ( см. рис. 37 на стр. [15]
Страницы: 1