Активность - гидроокись
Cтраница 1
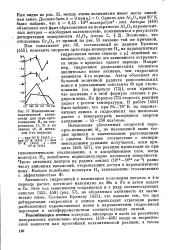 |
Изменение каталитической активности для пара-орто-конверсии Н2 на гидроокисях ( 1 2 ж на окисях ( 3, 4 металлов 4-го периода. [1] |
Активность гидроокисей с изменением положения металла в 4 - м периоде растет, достигает максимума на Мп и Fe и затем падает к Со. Этот ход зависимости сохраняется и в ряду соответствующих окислов [455, 458] ( рис. 57), но абсолютная активность их значительно ниже. [2]
Следует отметить, что активность гидроокисей триалкилосвинца по отношению к ацетиленовым соединениям выше, чем у соответствующих оловоорга-нических соединений. Очевидно, это обусловлено более высокой полярностью связи металл - кислород при переходе от олова к свинцу, достигающей в случае R3PbOH ионного состояния. [3]
Харнед и Кук [40] определили одновременно коэффициенты активности гидроокисей и хлоридов в смесях. Это первое исследование, в котором были непосредственно определены коэффициенты активности обоих компонентов ( электролитов) в смеси. [4]
При этом показано, что в интервале температур 35 - 85 и давлении 13 - 55 атм при концентрации гидроокиси натрия 1 - 5 г-экв скорость образования формиата натрия пропорциональна концентрации окиси углерода в жидкой фазе и активности гидроокиси натрия в растворе. [5]
Следующая, расположенная ниже первой, кривая ( черные кружки) изображает логарифм коэффициента активности хлорида в растворе гидроокиси. Значения логарифма коэффициента активности гидроокиси IgYifoi и логарифма коэффициента активности хлорида lgY9 ( 0) B чистой воде обозначены стрелками с левой и с правой стороны графика. Аналогичным образом две нижние кривые изображают логарифмы коэффициентов активности системы гидроокись натрия - хлорид натрия. [6]
Следующая, расположенная ниже первой, кривая ( черные кружки) изображает логарифм коэффициента активности хлорида в растворе гидроокиси. Значения логарифма коэффициента активности гидроокиси IgYito) и логарифма коэффициента активности хлорида lgY2 ( 0) B чистой воде обозначены стрелками с левой и с правой стороны графика. Аналогичным образом две нижние кривые изображают логарифмы коэффициентов активности системы гидроокись натрия - хлорид натрия. Белыми кружками обозначены значения логарифма коэффициента активности гидроокиси натрия в растворе хлорида натрия, а черными кружками - значения коэффициента активности хлорида натрия в той же смеси. [7]
Их используют также при возведении плотин, в дорожном и аэродромном строительстве. Наиболее перспективными являются грунтосиликат-ные материалы, преимущества которых определяются высокой хим. активностью гидроокисей щелочных металлов и широким диапазоном заполнителей - грунтов, что позволяет при миним. [8]
Как мы знаем, скорость растворения водных окисей алюминия в щелочах и кислотах неодинакова. Наиболее быстро растворяется гидраргиллит, медленнее бемит и наиболее медленно диаспор. Активность гидроокисей алюминия, а также окисей зависит не только от их природы, но и от условий получения и степени дисперсности. [9]
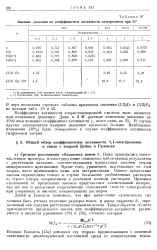 |
Влияние давления на коэффициенты активности электролитов при 25. [10] |
Коэффициент активности хлористоводородной кислоты мало меняется при изменении давления. Наибольшее изменение ( 10 %) было обнаружено в случае коэффициента активности гидроокиси натрия. [11]
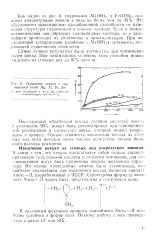 |
Осаждение некаля с при -, мепением солен Mg, Л ], Fe, Zn. [12] |
Это обусловлено зависимостью адсорбционной способности от изменения структуры гидроокисей в течение времени. Если в момент возникновения они образуют хлопьевидные частицы, то в дальнейшем происходит их уплотнение и кристаллизация. При последующей дегидратации ( особенно у Л1 ( ОН) 3) активность гидроокисей существенно снижается. [13]
Окись магния получают в виде очень тонкого белого порошка, пригодного и для ТСХ и для высокоэффективной хроматографии в колонке. Полагают, что поверхностные гидроксильные группы играют важную роль в механизме адсорбции. При нагревании до 150 С гидроокись магния теряет различные количества физически адсорбированной воды. При нагревании до 35О С активность гидроокиси магния резко возрастает вследствие потери гидроксильных и образования окисных групп. При дальнейшем нагревании активность адсорбента уменьшается, и, если температура нагревания превышает 1ООО С, он становится совершенно инертным. Активированная окись магния хемосорби - рует ароматические соединения. Чтобы избежать этого, адсорбент активируют при 500 С в течение 16 ч, а после этого дезактивируют 3 - 7 % воды. [14]
Следующая, расположенная ниже первой, кривая ( черные кружки) изображает логарифм коэффициента активности хлорида в растворе гидроокиси. Значения логарифма коэффициента активности гидроокиси IgYito) и логарифма коэффициента активности хлорида lgY2 ( 0) B чистой воде обозначены стрелками с левой и с правой стороны графика. Аналогичным образом две нижние кривые изображают логарифмы коэффициентов активности системы гидроокись натрия - хлорид натрия. Белыми кружками обозначены значения логарифма коэффициента активности гидроокиси натрия в растворе хлорида натрия, а черными кружками - значения коэффициента активности хлорида натрия в той же смеси. [15]
Страницы: 1 2