Комплекс - железо
Cтраница 3
Синтезированы комплексы железа ( П) с гексафтормонотиоаце-тилацетоном [38] и диэтилдитиокарбаминатом [72], однако нет сведений об их газохроматографическом поведении. [31]
 |
Электропроводность растворов соединений платины ( IV в зависимости от их состава. [32] |
Рассмотрим комплекс железа с лигандами, обладающими слабым электрическим полем. К таким лигандам относятся, например, молекулы воды. [33]
Все комплексы железа ( Ш) с разным содержанием тиоцианатогрупп окрашены в красный цвет и в растворе находятся в равновесии друг с другом. [34]
Трис-1 10-фенантролиновый комплекс железа ( П) [ Fe ( Phen) 3 ] 2 является низкоспиновым комплексом, имеет большую константу устойчивости и окрашен в интенсивно-красный цвет. Соответствующий бис-комплекс меди ( I) [ Cu ( Phen) 2 ] менее устойчив. Введение метальных групп в положение 2 9 создает стерическое затруднение, препятствующее образованию трис-комплекса железа ( II); образующийся высокоспиновый бис-комплекс железа ( II) бесцветен. [35]
Наиболее широко применяемый дифосфатный комплекс железа ( II) может быть заменен целым рядом других сочетаний. [36]
Образование комплексов железа служит качественной реакцией для обнаружения fj - дикарбонильных соединений ( см. разд. [37]
Образование комплексов железа служит качественной реакцией для обнаружения р-дикарбонильных соединений ( см. стр. Реакция происходит уже с соединениями, содержащими Д-2 % енола. Так как малоновый эфир и его производные не енолизованы в заметной степени, они не дают реакции с хлорным железом. [38]
Неустойчивость комплексов железа ( III) и алюминия ( III) подтверждается результатами опытов Лонга [ L37 ] по разложению этих комплексов при прибавлении кальций-ионов для осаждения, избытка оксалат-иона, не вошедшего в состав комплекса. [39]
Образование комплексов железа используют как качественную реакцию для обнаружения р-дикарбонильных соединений ( см. разд. Реакция протекает уже при содержании 1 - 2 % енолов. Характерное для хелатного комплекса окрашивание наблюдается только в спиртовом растворе. В водном растворе помимо этого комплекса присутствуют простые соли, также окрашенные. Так, например, фенолы, не содержащие хелатообразующую группу, дают цветную реакцию с хлоридом железа ( III) только в водном растворе, что связано с образованием основных солей. [40]
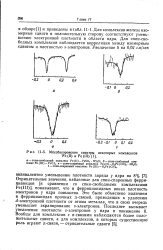 |
Мессбауэровские спектры некоторых комплексов Fe ( II и Ре ( Ш. [41] |
Для комплексов железа изомерные сдвиги в положительную сторону соответствуют уменьшению электронной плотности в области ядра. Для спин-свободных комплексов наблюдается корреляция между изомерным сдвигом и плотностью s - злектронов. [42]
Образование комплекса железа ( III) и тиомочевины происходит медленно, но каталитически ускоряется добавлением солей меди. К довольно разбавленному раствору соли железа ( III) прибавляют около 0 25 г сульфата меди и 3 - 5 г сульфата аммония, затем сразу вводят тиомочевину, смесь сильно взбалтывают и, когда она обесцветится, титруют. [43]
Устойчивость комплексов железа, образующихся в растворах цитратов аммония, в широком интервале рН ( от 2 до 10) позволяет проводить растворение соединений железа, меди и пассивацию в одном и том же объеме раствора. С этим же связана возможность вытеснения промывочного раствора моноцитрата аммония амминированной водой. Устойчивость цитратных комплексов железа справедлива лишь для аммиачной среды. Следует иметь в виду, что добавление в раствор других щелочей недопустимо, так как оно приведет к выпадению гид-роксида железа из раствора. [44]
Растворы комплексов железа с сульфосалициловой кислотой подчиняются закону Ламберта - Бера. Содержание железа находят методом сравнения оптической плотности исследуемого и стандартного растворов. Цветность воды не должна быть более 25 по платиново-ко-бальтовой шкале. [45]
Страницы: 1 2 3 4 5