Комплекс - металл
Cтраница 3
Поэтому комплексы металлов с различными сульфопроизводными органических реактивов в обычных условиях не извлекаются органическими растворителями. [31]
Некоторые комплексы металлов, идентифицированные в органической фазе при экстракции аминами, приведены в табл. 9.6. Везде, где это было возможно, предпочтение оказывалось спектральному методу. [32]
Некоторые комплексы металлов, идентифицированные в органической фазе при экстракции аминами, приведены в табл. 9.6. Везде, где это было возможно, предпочтение оказывалось спектральному методу. [33]
Если комплекс металла образован одним центральным ионом металла, то его называют одноядерным комплексом. Комплекс, в состав которого входит более одного иона металла, называют многоядерным комплексом. [34]
Многие непрочные комплексы металлов с кислотными остатками, считавшиеся раньше внутрисфср-ными, в водном растворе существуют только в виде внешнесферных: [ Со ( Н2О) 6 ] 2 - Вг, [ № ( Н2О) 6 ] 2 - С1 - вместо [ СоВг ], [ № С1 ] и др. Такие комплексы играют важную роль в механизмах реакций обмена. [35]
Способность комплексов металлов с 8-оксихинолином типа CXLII экстрагироваться хлороформом объясняется отсутствием в них полярных групп. [36]
Образование комплексов металла протекает по уравнения. [37]
Строение комплексов металлов этого типа будет обсуждено в последующих главах, а здесь достаточно лишь отметить, что плоское кольцо тетрапиррольного ядра вынуждает металл координироваться в квадратно-плоскостном или почти квадратно-плоскостном окружении. [38]
Использование комплексов металлов ( особенно отрицательно заряженных комплексных ионов) сильно расширяет возможности ионообменного разделения металлов. Большинство металлов в обычных водных растворах существует в виде катионов, разница в их сорбируемости катионитами сравнительно невелика, так что их разделение ограничено. При образовании отрицательно заряженных комплексных ионов или незаряженных комплексов металлов возможности разделения увеличиваются. [39]
Образование комплексов металлов в системе (1.88) сопровождается изменением окислительно-восстановительного потенциала вследствие того, что катионы образуют комплексы, имеющие различную устойчивость. [40]
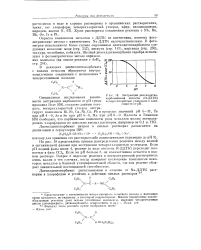 |
Экстракция диэтилдитио-карбаминовой кислоты ( Н - ДДТК четыреххлористым углеродом в зависимости от рН. [41] |
Окраска комплексов металлов с ДДТК не интенсивна, поэтому фотометрические методы с применением Na-ДДТК малочувствительны. В фотометрии используются более сильно окрашенные диэтилдитиокарбаматы следующих металлов: меди ( стр. Желтый диэтилдитиокарбамат серебра используют в фотометрическом методе определения мышьяка ( на основе реакции с AsH3, стр. [42]
Строение комплексов металлов с гетероциклическими азосоеди-нениями может быть объяснено с привлечением магнитных и ди-польных моментов этих комплексов. Так, в работе [194] обсуждается строение комплексов ПАН-2 и 1 - ( 2-бензтиазолилазо) - 2-нафтола с кобальтом, кадмием, никелем и цинком. Авторы отмечают, что у кобальта осуществляется октаэдрическая конфигурация, для других комплексов она может быть тетраэдрической, без координационной связи с атомом азота гетероцикла. Различие в строении комплексов может быть объяснено и различной основностью донорных атомов азота гетероцикла - она выше у пиридина и ниже у бензтиазола. Существенно влияет на строение комплекса природа растворителя. Если использовать хлороформ, то координационная связь с атомом азота гетероцикла может разрываться и частично будет образовываться тетраэдр ическая структура с сильно поляризованными связями. [43]
Устойчивость комплексов металлов с ЭДТА зависит от рН раствора. При рН 9 25 оба металла образуют прочные комплексы. На этом основано их совместное определение. [44]
Состав комплексов металлов с мурексидом зависит от рН раствора. Так, в слабощелочной среде цинк образует с мурексидом комплекс с соотношением реагирующих компонентов 1: 1, а в щелочной среде - комплекс ZnR2 - Мурексид чаще всего применяют при титровании ионов кальция. [45]
Страницы: 1 2 3 4