Возникающий комплекс
Cтраница 1
Возникающий комплекс ( С2Н4Х) будет устойчив, только если для заполнения всех трехцентровых МО имеются всего два электрона. [1]
Диссоциация возникающих комплексов происходит с таким трудом, что во многих случаях получение макроциклов, не содержащих металла, представляет сложную проблему. Циклические полиамины были получены также прямой конденсацией диаминов с карбонильными соединениями. После выделения свободного амина могут быть получены его комплексы с ионами других металлов. [2]
 |
Комплексные соединения с центральными атомами разного заряда. [3] |
Они определяют устойчивость возникающего комплекса, что можно проиллюстрировать простой электростатической моделью. Высокозарядные ионы малого размера образуют устойчивые комплексы. [4]
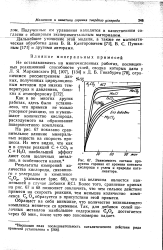 |
Зависимость состава продуктов горения от времени контакта кислорода с углем и природы катализатора. [5] |
Обращает на себя внимание, что количество возникающего комплекса меняется со временем. Так, для добавок солей щелочных металлов наибольшее содержание С ОУ достигается через 60 мин. [6]
Характерной особенностью плотных паров является наличие в них спонтанно возникающих комплексов - кластеров. Концентрация кластеров становится значительной вблизи линии насыщения, если параметры состояния приближаются к критическим. Специфика паров щелочных металлов заключается в том, что потенциалы ионизации содержащихся в них кластеров сравнительно низки. [7]
Сдвиг электронной пары в сторону кислорода пирокатехина понижает по сравнению с фенолом устойчивость возникающего комплекса. Ослабление связи водорода с фенильным радикалом при введении в последний второй гидроксильной группы подтверждается повышением константы диссоциации К. [8]
Медноаммиачный раствор содержит главным образом ионы Cu ( NH3) 4 - Строение возникающих комплексов точно не установлено, однако в образовании его, несомненно, принимает участие два гидроксила, преимущественно при соседних углеродных атомах. В результате изучения данной реакции с соединениями, обладающими жесткой конформацией, Ривс пришел к выводу, что при очень небольшой величине двугранного угла ( как в цис-2 3-диокситетрагидрофуране) между двумя гидроксильными группами наблюдается очень сильное комплексообразование. Образование комплекса иногда происходит с участием двух аксиальных гидроксилов, например в случае 1 6-ангидро - З - О-метил-р - в-глюкозы. На основании сказанного был сделан вывод, что необходимое для ком-плексообразования расстояние между кислородными атомами не должно превышать 3 45 А. [9]
Вопрос о ближней и дальней гидратации ионов Крестов рассматривает с позиций преимущественного взаимодействия ион - молекулы воды и влияния возникающего комплекса на связи между самими молекулами воды. При оценке первого взаимодействия, названного термодинамической гидратацией, решающее значение имеет первичная гидратация ионов, определяющая структуру образующихся гидратов и вносящая наибольший вклад в энергетику процесса. Кроме координационных чисел, которые в данном случае имеют целочисленное значение, важнейшими количественными характеристиками процесса гидратации являются изменения термодинамических величин - энтальпии, энтропии, теплоемкости и изобарно-изотермического потенциала. [10]
Соединения, способные присоединяться к свободной электронной паре - электронные акцепторы или кислоты Льюиса, играют роль катализаторов в тех случаях, когда возникающий комплекс обладает повышенной реакционной способностью. Опыт показывает, что апротонные кислоты катализируют те же реакции, что и протонные кислоты, причем активность апротонных кислот иногда выше, чем протонных. Возникающие комплексы имеют ионный характер и даже иногда диссоциированы с образованием промежуточного активного продукта катионного типа. [11]
В связи с таким первичным механизмом действия металлов особое значение должны иметь как избирательное сродство катиона металла к тем или иным рецепторам - анионным группам на поверхности или внутри клетки, так и сила образующихся при их взаимодействии связей, иначе говоря, прочность возникающих комплексов. [12]
Из уравнения (2.83) следует, что для определения состава и констант устойчивости возникающих комплексов достаточно измерить коэффициенты распределения металла при разных рН и концентрации. [13]
Электрофильный катализ ( см. Катализ) относится к кислотному катализу, роль катализаторов играют соединения, способные присоединиться к свободной электронной паре, - электронные акцепторы, или кислоты Льюиса. Присоединение кислоты Льюиса к субстрату, содержащему свободную электронную пару, сопровождается повышением реакционной способности возникающего комплекса. Этот комплекс имеет ионный характер или даже диссоциирован с образованием активного промежуточного продукта катионного типа. Установлено, что некоторые типично кислотные процессы ускоряются в растворах в присутствии ионов металлов - кислот Льюиса. [14]
Соединения, способные присоединяться к свободной электронной паре - электронные акцепторы или кислоты Льюиса, играют роль катализаторов в тех случаях, когда возникающий комплекс обладает повышенной реакционной способностью. Опыт показывает, что апротонные кислоты катализируют те же реакции, что и протонные кислоты, причем активность апротонных кислот иногда выше, чем протонных. Возникающие комплексы имеют ионный характер и даже иногда диссоциированы с образованием промежуточного активного продукта катионного типа. [15]
Страницы: 1 2