Цианидный комплекс - медь
Cтраница 1
Цианидный комплекс меди ( I) K2 [ Cu ( CN) 3 ] вместе со станнатом натрия Na2SnO3 в щелочной среде используют для нанесения на поверхности металлических изделий защитного слоя бронзы или для придания им бронзового оттенка. Для этих соединений меди и олова потенциалы электроосаждения близки, что является непременным условием образования сплавов. [1]
Однако с помощью инфракрасной спектроскопии были изучены равновесия цианидных комплексов меди ( 1) [121] и серебра [82] в водном растворе. Полосы, обусловленные связью QsN, появлялись между 2076 и 2135 слг1 как для свободных цианид-ионов, так и для различных комплексов и были четкими даже в водных растворах. Поэтому получающиеся значения К3 и Ki были только приближенными, и так как концентрация цианид-ионов сильно изменялась, то дальнейшие неточности были введены из-за поправок на коэффициенты активности. Однако, если располагать лучшими методами получения инфракрасных спектров в водных растворах, возможно, что инфракрасная спектроскопия станет удобным средством изучения равновесия в водном растворе. [2]
Анализ приведенных данных показывает, что основная причина отмеченных расхождений, по всей вероятности, заключается в составе цианидных комплексов меди, которые находятся в исследованных электролитах. [3]
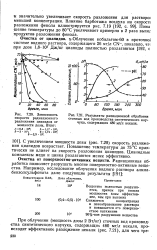 |
Результаты радиационной обработки сточных вод производства синтетического каучука, содержащих 480 мг / л некаля. [4] |
С увеличением мощности дозы ( рис. 7.20) скорость разложения цианидов возрастает. Повышение температуры до 75 С практически не влияет на скорость разложения цианидов. Цианидные комплексы меди и цинка разлагаются менее эффективно. [5]
Ни едкий натр, ни тем более гидроокись аммония, ни даже сероводород не осаждают из раствора этого комплекса соответствующих осадков. Наоборот, все нерастворимые в воде соединения меди образуют с цианидом калия комплекс и переходят таким образом в растворимое соединение. Более того, относительно устойчивый синий аммиачный комплекс меди [ Cu ( NH3) 4 ] 1 получаемый при действии избытка гидроокиси аммония на ионы меди, обесцвечивается цианидом калия и переходит в еще более устойчивый цианидный комплекс меди. [6]
Ни едкий натр, ни тем более гидроокись аммония, ни даже сероводород не осаждают из раствора этого комплекса соответствующих осадков. Наоборот, все нерастворимые в воде соединения меди образуют с цианидом калия комплекс и переходят таким образом в растворимое соединение. Более того, относительно устойчивый синий аммиачный комплекс меди [ Си ( МНз) 4 ]) получаемый при действии избытка гидроокиси аммония на ионы меди, обесцвечивается цианидом калия и переходит в еще более устойчивый цианидный комплекс меди. [7]
Ни едкий натр, ни тем более раствор аммиака, ни даже сероводород не осаждают из раствора этого комплекса соответствующих осадков. Наоборот, все нерастворимые в воде соединения меди образуют с цианидом калия комплекс и переходят таким образом в растворимое соединение. Более того, относительно устойчивый синий аммиачный комплекс меди [ Cu ( NH3) 4 ] 2, получаемый при действии избытка аммиака на ионы меди, обесцвечивается цианидом калия и переходит в еще более устойчивый цианидный комплекс меди. [8]
Ни едкий натр, ни тем более гидроокись аммония, ни даже сероводород не осаждают из раствора этого комплекса соответствующих осадков. Наоборот, все нерастворимые в воде соединения меди образуют с цианидом калия комплекс и переходят таким образом в растворимое соединение. Более того, относительно устойчивый синий аммиачный комплекс меди [ Cu ( NH3) 4 ] 4, получаемый при действии избытка гидроокиси аммония на ионы меди, обесцвечивается цианидом калия и переходит в еще более устойчивый цианидный комплекс меди. [9]
Никель и кобальт обладают очень близкими химическими свойствами, восстанавливаясь почти при одном и том же напряжении. Для определения никеля в присутствии кобальта, например в продуктах кобальтового производства, удобно полярографировать оба элемента в растворе гидроокиси аммония и хлористого аммония или пиридина и его хлористоводородной соли. Кобальт связывается этими веществами сильнее, чем никель, и на полярограм-ме получается отдельная волна никеля. Влияние меди и никеля при определении цинка легко устранить прибавлением раствора цианистого калия. Цианидный комплекс меди настолько устойчив, что не дает полярографической волны. [10]
 |
Полярограмма раствора трилоната кадмия в присутствии ионов циркония. [11] |
Никель и кобальт обладают очень близкими химическими свойствами и восстанавливаются почти при одинаковом напряжении. Для определения никеля в присутствии кобальта, например в продуктах кобальтового производства, удобно поляро-графировать оба элемента в растворе гидроокиси аммония и хлористого аммония или в смеси пиридина и его хлористоводородной соли. Кобальт связывается этими комплексообразователями сильнее, чем никель, и на полярограмме получается отдельная волна никеля. Влияние избытка меди при определении цинка легко устранить прибавлением раствора цианистого калия. Цианидный комплекс меди настолько устойчив, что вообще не дает полярографической волны. [12]
Никель и кобальт обладают близкими химическими свойствами и восстанавливаются почти при одном и том же потенциале. Для определения никеля в присутствии кобальта, например в продуктах кобальтового производства, удобно полярографировать оба элемента в растворе аммиака и хлорида аммония или пиридина и его хлорида. Кобальт связывается этими веществами сильнее никеля, и на поля-рограмме получается отдельная волна никеля. Влияние меди при определении цинка легко устранить, прибавляя раствор цианида калия. Цианидный комплекс меди настолько устойчив, что не дает полярографической волны. Для раздельного определения железа и меди применяют раствор ЭДТА. [13]
Подобно диацидо-комплексам ртути ( II), соответствующие комплексы меди ( I) и серебра не полностью насыщены, а проявляют способность к превращению в три - и тетра-комплексы. Этот факт очевиден из приведенных в табл. 6 констант устойчивости, которые, хотя и не позволяют вычислить ни лиганд-эффект, ни соответствующие полные эффекты, все же косвенно показывают, что кривая образования должна иметь остановку после связывания двух первых лигандов. Эта остановка, по-видимому, увеличивается с ростом сил связи, посредством которых присоединены два первых лиганда, и, в целом, она больше для системы комплексов ртути ( II), чем для систем меди ( I) и серебра. Это видно не только из результатов исследования систем, для которых известен порядок величин & з и / С2, но также из данных для цианидных систем, где, кроме произведения четырех ступенчатых констант, известен порядок величины четвертой ступенчатой константы. Так, для систем цианидных комплексов меди ( I), ртути ( II) и цинка характерно, что четвертая ступенчатая константа во всех этих системах равна приблизительно одной величине, несмотря на то, что в двух первых указанных системах / С4 значительно больше, чем в системе комплексов цинка. [14]
Реакцию необходимо вести в отсутствие СН - - ионов, образующих с Си 4 - - ионами осадок Cu ( CN) 2, быстро разлагающийся на цианид закисной меди и дициан ( CN) a. Цианид меди с избытком цианида калия образует растворимое в воде очень устойчивое комплексное соединение K3 [ Cu ( CN) J. Ни едкий натр, ни, тем более, гидроокись аммония, ни даже сероводород не осаждают из раствора этого комплекса соответствующих осадков. Наоборот, все нерастворимые в воде соединения меди образуют с цианидом калия комплекс и переходят таким образом в растворимое соединение. Более того, относительно устойчивый синий аммиачный комплекс меди [ Cu ( NH3) 4 ], получаемый при действии избытка гидроокиси аммония на ионы меди, обесцвечивается цианидом калия и переходит в еще более устойчивый цианидный комплекс меди. [15]
Страницы: 1