Внутриорбитальный комплекс
Cтраница 2
Соединения с координационным числом 6 имеют окта-эдрическую структуру. Критерием для определения типа гибридизации могут служить опытные данные о магнитных свойствах образуемых комплексов. Внутриорбитальные комплексы диамагнитны или содержат 1 - 2 неспаренных электрона и поэтому называются низкоспиновыми, а внешнеорбиталь-ные - парамагнитны, содержат 3 - 5 неспаренных электронов и относятся к высокоспиновым. [16]
Низкоспиновый ион может принимать 6 пар электронов от атомов азота трех молекул лигандов. Эти электроны занимают с / 25р3 - гибридные орбита-ли. Ион может быть описан как ковалентный или внутриорбитальный комплекс. Возбужденное состояние обозначено звездочкой. [17]
Теория валентных связей правильно предсказывает наличие двух вариантов для числа неспаренных электронов, но не позволяет сделать выбор между ними. С точки зрения этой теории внутриорбитальные комплексы должны быть относительно инертными. Экспериментальные наблюдения, указывающие, что внешнеорбитальные комплексы обычно действительно более лабильны, чем внутриорбитальные комплексы, убеждают нас, что теория валентных связей представляет собой по меньшей мере шаг в правильном направлении. В свое время она явилась несомненным достижением, однако впоследствии была вытеснена теорией кристаллического поля и еще более совершенной теорией поля лигандов, или делокализованных молекулярных орбиталей. [18]
К участию в гибридизации в таких случаях привлекают 4rf - AO, орбитали более высокой энергии. Комплексы, в которых в образовании химических связей участвуют вместе с ns - и пр - АО вакантные nd - AO, называют внешнеорбитальными. Комплексы, в которых в гибридизации АО участвуют вместе с ns - и пр - АО вакантные ( п - Drf-АО, называют внутриорбитальными комплексами. [19]
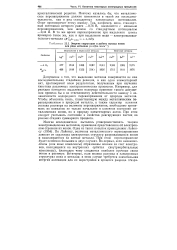 |
Энергия гидратации и работы выхода ионов для ряда металлов ( в кДж - моль . [20] |
По Лайонсу, величина металлического перенапряжения зависит от характера электронных структур разряжающихся ионов и выделившегося на катоде металла. Во-первых, если аквакомп-лексы ( или иные комплексы) образованы ионами за счет электронов, находящихся на внутренних орбитах ( внутриорбитальные комплексы), благодаря чему создаются наиболее прочные связи ионов в растворе. Во-вторых, если велика разница в электронных структурах иона и металла; в этом случае требуется значительная энергия активации для их перестройки в процессе разряда. [21]
По Лайонсу, величина металлического перенапряжения зависит от характера электронных структур разряжающихся ионов и выделившегося на катоде металла. Во-первых, если аква-комплексы ( или иные комплексы) образованы ионами за счет электронов, находящихся на внутренних орбитах ( внутриорбитальные комплексы), благодаря чему создаются наиболее прочные связи ионов в растворе. Во-вторых, если велика разница в электронных структурах иона и металла; в этом случае требуется значительная энергия активации для их перестройки в процессе разряда. Разряжающиеся ионы имеют обычно иную структуру, чем ионы, присутствующие в растворе. Это обстоятельство связано с тем, что при адсорбции на электроде происходит частичная диссоциация простого гидратированного или комплексного иона. Освобождающиеся связи удерживают ион на поверхности электрода, причем до момента разряда идет дальнейшая перестройка его электронной структуры в направлении, сближающем ее со структурой иона в металле. [22]
Страницы: 1 2