Октаэдрический комплекс - переходный металл
Cтраница 1
 |
Хиральность в плоскоквадратном комплексе [ Pt ( Cptn2 ] 2 обусловлена хираль. [1] |
Октаэдрические комплексы переходных металлов можно разделить на два типа: инертные ( или прочные) и лабильные ( равновесные) комплексы. Для данного лиганда инертность может сильно изменяться в зависимости от природы центрального атома. Например, этилендиаминовые комплексы Со ( III), Сг ( III) и платины довольно инертные, в то же время эти комплексы с Со ( II), Сг ( II), Си ( II), Ni ( II) и Zn ( II) являются лабильными. [2]
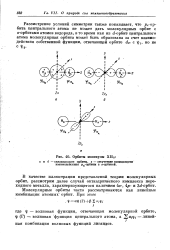
Рассмотрим октаэдрический комплекс переходного металла, лиганды которого не проявляют склонности к образованию тг-связей. Из шести АО лигандов и девяти АО комплексообразователя возникают 15 МО. [3]
Рассмотрим октаэдрический комплекс переходного металла, ли-ганды которого не проявляют склонности к образованию я-связей. Из шести АО лигандов и девяти АО комплексообразователя возникают 15 МО. Для образования а-связей пригодны шесть орбиталей: dz, dx - y i s, px, py, pz, так как ветви их лежат вдоль прямых, соединяющих атомы металла и лиганда. Остальные три орбитали ( dxy, dxz, dyz) являются несвязывающими, так как их электронные облака направлены между лигандами, и энергия этих орбиталей практически не меняется. [4]
Рассмотрим октаэдрический комплекс переходного металла, лиганды которого не проявляют склонности к образованию тг-связей. Из шести АО лигандов и девяти АО комплексообразователя возникают 15 МО. [5]
Октафенилтрихлорсилан 323, 369 Октаэдрические комплексы переходных металлов 19 и ел. [6]
Если даже ограничиться рассмотрением только октаэдрических комплексов переходных металлов первого ряда, то и для них имеется большое разнообразие, так как у них может быть до 10 d - электронов и до 5 неспаренных электронов. Для переходных металлов второго и третьего рядов спин-орбитальное взаимодействие возрастает, так что наблюдение и интерпретация спектров ЭПР их комплексов становится еще гораздо труднее. [7]
 |
Орбиты молекулы ХН2. [8] |
В качестве иллюстрации представлений теории молекулярных орбит, рассмотрим далее случай октаэдрического комплекса переходного металла, характеризующегося наличием 4s -, 4p - и Зй-орбит. [9]
 |
Потери в ЭСКП для октаэдрических комплексов. [10] |
Таким образом, видно, что методы валентных связей и кристаллического поля приводят к качественному объяснению реакционной способности октаэдрических комплексов переходных металлов. Однако при этом метод кристаллического поля более удовлетворителен, так как дает по крайней мере частичное объяснение относительной скорости реакций в ряду комплексов, которые в противном случае просто относятся к лабильным или инертным. Тем не менее, нужно подчеркнуть, что метод кристаллического поля здесь является слишком упрощенным, так как предпвлагает идеальную геометрию различных многогранников и игнорирует такие факторы, как отталкивание лиганд-лиганд. [11]
Понижение симметрии равновесной конфигурации приводит к нескольким эквивалентным минимумам, переходящим друг в друга при операциях группы высокой симметрии, не входящих в число операций группы образующейся равновесной конфигурации. Для октаэдрических комплексов переходных металлов за счет эффекта Яна-Теллера ( первого порядка) появляется 3 эквивалентных минимума, отвечающих октаэдру, вытянутому или сжатому по одной из его трех осей 4-го порядка. [12]
Теория Таубе относится лишь к комплексам октаэдрического типа. Однако необходимо отметить, что октаэдрические комплексы переходных металлов являются наиболее распространенными. [13]
Теория МО составляет основу для понимания природы переходов ПЗ ( см. гл. На рис. 11.9 представлена диаграмма МО октаэдрического комплекса переходного металла. Указанные МО можно грубо разделить на такие, которые локализованы вблизи лигандов, например, 0L и л [, и такие, которые локализованы вблизи центрального иона, например, ам и ям. Переходы между состояниями, преимущественно локализованными на центральном ионе ( переходы в поле лигандов, d - d - переходы), не вызывают существенного перераспределения электронной плотности между центральным ионом и лигандами и при определенных условиях могут приводить к реакциям фотоизомеризации и фотозамещения ( см. гл. [14]
Страницы: 1 2
