Арсенопирит
Cтраница 1
Арсенопирит ( мышьяковый колчедан) - по структуре сходен с марказитом. Внешняя форма соответствует ромбической син-гонии, рентгенометрически определяют моноклинную даже триклинную сингонии. В открытой трубке дает возгон белого цвета ( As2O3), остаток чернеет; в закрытой трубке возгон сначала имеет красный цвет ( AsnSn), а затем - серо-белый цвет с металлическим блеском - мышьяковое зеркало ( кристаллический мышьяк), а далее образует налет черного цвета - аморфный мышьяк. [1]
Арсенопирит встречается почти во всех месторождениях сульфидных руд, кварцевых жилах золото-арсенопиритовой формации и в жилах совместно с рудами тяжелых металлов - Мо, W, Sn, Bi. При окислении образует различные арсенаты Fe; среди них самый характерный - скородит Fe ( AsOi) 2Н2О - наблюдается в виде налетов светло-зеленого, красноватого или бурого цвета, особенно хорошо заметных на белом кварце. [2]
Арсенопирит - природное соединение, представляет собой твердое кристаллическое вещество черного цвета, нерастворимое в воде и органических растворителях, растворяется в концентрированной азотной кислоте с выделением серы. При нагревании выше 500 С теряет мышьяк. [3]
Арсенопирит ( рис. 91) выпадает в пневматолитовых жилах с вольфрамитом, молибденитом, флюоритом и бериллом, а также выделяется из горячих водных растворов и характеризует наиболее глубинные кварцевые жилы. В СССР известен на Северном Кавказе и в Грузии, на Урале, в Средней Азии и во многих местах Сибири. [4]
Поведение арсенопирита при окислительном обжиге во многом аналогично поведению пирита. [5]
С арсенопиритом, эна [ нитом, лимонитом и пр. [6]
Для растворения арсенопирита тонко измельченную навеску пробы сперва обрабатывают при комнатной температуре водным раствором брома и бромида натрия, затем осторожно малыми порциями добавляют азотную кислоту и выпаривают досуха. Нитраты, если желательно, могут быть после этого превращены в хлориды или сульфаты. [7]
Для растворения арсенопиритов тонкоизмельченную пробу обрабатывают при комнатной температуре водным раствором брома и NaBr, затем осторожно малыми порциями добавляют HN03 и выпаривают досуха. Если дальнейший ход анализа требует удаления нитратов и превращения солей в хлориды или сульфаты, то это можно легко сделать выпариванием с соответствующей кислотой. [8]
Для растворения арсенопирита тонко измельченную навеску пробы сперва обрабатывают при комнатной температуре водным раствором брома и бромида натрия, затем осторожно малыми порциями добавляют азотную кислоту и выпаривают досуха. Нитраты, если желательно, могут быть после этого превращены в хлориды или сульфаты. Металлический мышьяк, сульфид мышьяка ( III) и большинство арсенидов тяжелых металлов могут быть растворены в дымящей азотной кислоте или в царской водке. Арсениды, не растворяющиеся при такой обработке, сплавляют со смесью соды и селитры или суспендируют в растворе едкого кали и обрабатывают хлором. Для разложения некоторых природных арсенатов требуется сплавление с содой. Если минерал полностью при этом не окисляется, прибавляют селитру, в присутствии же сурьмы соду заменяют поташом. [9]
Уран ассоциирует с арсенопиритом, сфалеритом, галенитом, сидеритом халькопиритом. Руда содержит от 0 02 до 0 1 % окиси урана. [10]
Уран ассоциирует с арсенопиритом, сфалеритом, галенитом, сидеритом халькопиритом. Руда содержит от 0 02 до 0 1 % окиси урана. [11]
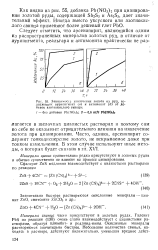 |
Зависимость извлечения золота из руд, содержащих аурипигмснт ( а и антимонит ( б от добавок азотнокислого свинца. [12] |
Часто, однако, арсенопирит содержит тонкодисперсное золото, не вскрываемое даже при тонком измельчении. В этом случае используют иные методы, о которых будет сказано в гл. [13]
Для окисления пирита и арсенопирита наиболее пригодны тионовые железобактерии ( Thiobacillus ferrooxidans), способные окислять сульфиды, сульфат закиси железа, элементарную серу, тиосульфат и другие ненасыщенные соединения серы. Механизм окисления сульфидов при бактериальном выщелачивании сложен. Считают, что участие тионовых железобактерий в окислении сульфидов может быть прямым и косвенным. [14]
Металлический мышьяк получают нагреванием арсенопирита без доступа воздуха в железных ретортах. Возгоняющийся при этом элементный мышьяк конденсируется в холодильниках. По другому способу металлический мышьяк получают восстановлением трехокиси мышьяка углем в железных ретортах. Возгоняющийся элементный мышьяк конденсируется в охлаждаемой разгрузочной части реторты. [15]
Страницы: 1 2 3 4