К-метил
Cтраница 3
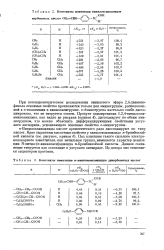 |
Константы ионизации го-ввнилоксиапилидов дикарбоновых кислот. [31] |
Винилоксианилиды кислот ароматического ряда диссоциируют по типу кислот. Под влиянием такого сильного электро-нодонорного заместителя, как метильная группа, изменяется характер ионизации К-метил - ( ге-винилокси) анилида и-бромбензойной кислоты. Данное соединение титруется как основание в уксусном ангидриде. Из донора оно становится акцептором протонов. [32]
Для изучения продуктов разложения гербицидных солей 4 4 -дипиридилия применен метод электрофореза на бумаге. Показано, что при повышенной температуре бискатион N, Ы - диметил-4, 4 -ди-пи ридилия переходит в катион К-метил - 4, 4 -пиридилпиридиния, а последний в 4, 4 -дипиридил. [33]
Если 4-метилциклогексиль-ная группа находится в г / ыс-положении. Этот вывод должен находиться в согласии с более обстоятельным исследованием Гольдберга и Лэма [108] стереохимии пиролитического элиминирования четырех изомерных окисей К-метил - М - неопентил-4 - метил-циклогексиламина ( например, 162Б; ср. Ситуация совершенно аналогична той. Переходное состояние для смк-элиминирования из 162 обладает более низкой энергией, если кислород отклонится вправо для того, чтобы вызвать отщепление протона от С-2, поскольку при этом происходит сближение метила с кольцом, тогда как отклонение влево для отщепления протона от С-6 должно приближать фенильную ( 162А) или неопентильную ( 162В) группу к метиленовому кольцу. [34]
Из данных, приведенных в табл. 1, следует, что родственные 2-оксшшридину соединения, в которых действующим может быть лишь один функциональный центр, а другой отсутствует или блокирован, К-метил - 2-пири-дон ( № 39, 43), 2-метоксшшридин ( № 44), пиридин ( № 40, 45), нитрофенолы ( № 26, 47), не ускоряют реакций как пептидообразования, так и ацилирования ариламинов бензоилфторидом. В то же время сам 2-оксшшридин ( № 37, 41) и его 5-бромпроизводное № 38, 42) являются эффективными катализаторами рассматриваемых реакций, которые наиболее сильно подвержены бифункциональному катализу. [35]
Фенильные радикальные промежуточные частицы образуются также при расщеплении связи С-Hal в 2-галоген - ] Ч - метил - К - ( 1-нафтил) бензамидах, подвергаясь затем внутримолекулярному замещению с образованием 1 т-метил-2 - ( 1-нафтил) бензамида. Никаких признаков ] т-метилбензо ( с) фенантридона обнаружено не было. При восстановлении 2-галоген - ] Ч - метил - К - ( 2-нафтил) бенза-мидов получены К-метил - 2 - ( 2-нафтилбензамид), Лт-метилбензо ( а) - фенантридон и ] Ч - метилбензо ( в) фенантридон. Наблюдалось и дальнейшее восстановление этих продуктов, но определенных выводов о ходе превращений сделать не удалось. Промежуточные анион-радикальные частицы, образующиеся при электрохимическом восстановлении производных карбоновых кислот, были использованы в работе [59] для получения целой гаммы продуктов. Из алкилбензоатов в сухом ацетонитриле получен бензо-илацетонитрил, из метилфенилглиоксалата - метил - З - циано-2 - гидрокси-2 - фенилпропионат, из 1Ч ] т-диалкилтиобензамидов - р1 - диалкиламиноциннамопитрилы. [36]
Тетраацетиль-ное производное бисдезоксистрептобиозамина ( 237) было частично дезацетилировано посредством раствора аммиака в метиловом спирте, в результате чего был выделен кристаллический М - ацетил-бисдез-оксистрептобиозамин. Это обстоятельство в сопоставлении с результатами гидролитического расщепления тетраацетильного производного бисдезоксистрептобиозамина ( 237), при котором был выделен К-метил - / - глюкозамин, является одним из доказательств того, что в молекуле стрептобиозамина стрептоза присоединена к глюко-зидному гидроксилу Н - метил - / - глю: озамина. [37]
Переключение буферных растворов через 230 мин. Порядок выхода и времена удерживания ( мин): / - L-оксипролин, ПО; 2 - L-треонин, 137; 3 - сар-козин, 163; 4 - К-метил - О. [38]
Реакции хиралытых а-аминокетонов имеют большое значение для изучения алкалоидов типа эфедрина и антибиотика левоми-цетина. Когда же аминогруппа алкилирована или ацилирована, то стереохимический контроль реакции изменяется и пятичленная циклическая модель должна быть заменена на открыто-цепную модель, в которой объемистая азотсодержащая группа выступает в качестве RL. Это наглядней всего видно из сравнения примеров № 1 и 18 - 21 в табл. 3 - 5; стереохимическое направление реакции восстановления под действием натрийборогидрида изменяется от соотношения 11: 1 в пользу эрытро-изомера ( исходя из а-аминопропиофенона) на соотношение 1: 10 в пользу mpeo - изомера при замене исходного а-аминопропиофенона на его К-метил - бензил-или М - бензил - К-бензоил-аналог. [39]
Хотя изучение химического строения оксистрептомицина полностью не закончено, однако опубликованные экспериментальные данные в. Составу оксистрептомицина отвечает суммарная формула C2iH39N7Oi3, сопоставление которой с суммарной формулой стрептомицина ( C2iH39N7Oi2) показывает, что в молекуле первого из этих антибиотиков содержится на один атом кислорода больше, чем в молекуле второго. Подобно стрептомицину, Оксистрептомицин дает положительную реакцию Сакагуши и пробу на присутствие остатка N-метил - / - - глюкозамина. Кислотный гидролиз оксистрептомицина приводит к образованию стрентидина ( 3) и К-метил - / - глюкозамина, выделенного в виде пентаацетильного производного ( 47) ( см. схему 9, стр. Эти результаты позволяют прийти к заключению, что дополнительный атом кислорода, имеющийся в молекуле оксистрептомицина и отсутствующий в молекуле стрептомицина, находится в стрептозном остатке первого из этих антибиотиков. [40]
Было несомненно, что этот гидроксил не является глюкозидным гидроксилом остатк. Было также мало вероятно, что этот гидроксил расположен при третьем углеродном атоме, так как ряд наблюдений говорил о том, что в молекуле стрептобиогамина содержится свободный третичный гидроксил, который может находиться только при третьем углеродном атоме остатка стрептозы. Наконец, как будто должен был быть исключен и гидроксил при пчтом углеродном атоме, так как из результатов окисления молекулы бисдез-оксистрептозы йодной кислотой следовало, что именно этот гидроксил участвует в образовании фуранозного кольца. Таким образом, остается только единственная возможность осуществления моноглюкозидной связи между остатками К-метил - / - глюкозамина и стрептозы, а именно за счет гидроксила, находящегося при втором углеродном атоме последней. [41]
Подобно пенициллинам стрептомицины являются в настоящее время одними из наиболее интенсивно исследуемых антибиотиков, причем основное внимание попрежнему привлекает к себе сам стрептомицин. Химическое изучение последнего недавно привело к окончательному выяснению не только его структурной формулы, но и пространственной конфигурации его молекулы. Кроме того, было обнаружено, что стрептомицин, повидимому, существует в двух таутомерных формах. Начали появляться и синтетические исследования по химии стрептомицина, в которых описан синтез некоторых из продуктов его расщепления - стрептидина, К-метил - / - глкжозамина и мальтола. [42]
До CHI пор из зтого класса соединений известны лишь немногие представители. Они содержат радикалы уксусной кислоты почти исключительно в а-п сложении. Соединения с раднка пом уксусной кислиты u P-I; сложении доступны вообще лишь с трудом. Из производных пиррола, содержащих дна остатка у к с у с и о и к и с л о т ы особую роль сыграл К-метил - 2, 5-ди ( кярб-оксиметил) пиррол, являющийся промежуточным продуктом при синтезе алкалоидов кокаина и атропина, разработкой которого R. Willstatter увенчал в 1920 г. свои успешные исследовании и этой области. [43]
Из сказанного следует, что изменение условий опыта, особенно изменение подвижности ионных пар может существенно повлиять на состав продуктов реакции. Исходя из предположения, что адсорбированные на поверхности частицы утрачивают значительную часть своей подвижности, была проведена серия опытов, в которых подвергали действию озона ряд третичных аминов, например К-метил - 2 2 6 6-тетраметил - 4-оксипиперидин, адсорбированных на силикагеле. [44]
ЭФФЕКТОРЫ ФЕРМЕНТОВ, изменяют скорость ферментативной р-ции. Конкурентные ингибиторы уменьшают константу Михаэлиса ( см. Ферментативных реакций кинетика), неконкурентные - макс, скорость р-ции. Активаторы влияют, как правило, на макс, скорость р-ции. Для ферментов, состоящих из неск. Это проявляется в изменении характера зависимости скорости р-ции ( или ф-ции насыщения фермента субстратом) от концентрации субстрата ( появление S-образной или др. типов негипербо-лич. ЭХИНОПСИН ( К-метил - 4-хинолон), хиноли-новый алкалоид, содержащийся в семенах мордовника обыкновенного ( Echinops ritrp L. [45]
Страницы: 1 2 3 4