Карбонат - литий
Cтраница 2
Карбонат лития растворим в разбавленных минеральных и уксусной кислотах и не выпадает в присутствии солей аммония. Следовательно, карбонат аммония не полностью осаждает ионы лития. [16]
Карбонат лития Li2CO3 при нагревании неустойчив и значительно менее растворим в воде, чем карбонаты других щелочных металлов. Растворимость Li2CO3 понижается при повышении температуры раствора, а также в присутствии Na2CO3 и К2СО3, что используется в промышленности для его осаждения. С солями других щелочных металлов ( кроме карбонатов) карбонат лития образует двойные и комплексные соли. Магний и алюминий при нагревании очень бурно ( с воспламенением) реагируют с Li2CO3, при этом литий восстанавливается до металлического. [17]
Карбонаты лития плохо растворимы, хлориды растворяются лишь в органических растворителях, карбонаты и нитраты неустойчивы при нагревании. [18]
Карбонат лития используется для получения многих солей лития. [19]
Карбонат лития Li2CO3 - бесцветные кристаллы, малорастворимые в воде; применяется в пиротехнике, в производстве пластмасс как катализатор, в: рной металлургии, в производстве стекла и керамики. Оксид лития 1Л2О - бесцветные кристаллы; легко реагирует с водой, поглощает СО. Гидроксид лития LiOH - бесцветные кристаллы, в воде менее растворимы, чем гидроксиды других щелочных металлов, большие количества потребляются как добавка к электролиту щелочных аккумуляторов, в органической химии для получения стеарата, оксисте-арата, олеата и пальмптата лития, используемых в производстве морозо-и термостойких смазок для авиации и военной техники; на подводных лодках LiOH применяют для поглощения С02 из воздуха. Сульфат лития Li2SO4 - бесцветные кристаллы, хорошо растворимые в воде; применяется в ультразвуковой дефектоскопии для изготовления головок щупов. [20]
Карбонаты лития и элементов ПА-группы известны только в безводном состоянии, а карбонаты Be и элементов IA-группы - гигроскопичные вещества, образующие кристаллогидраты с различным содержанием молекул воды. Карбонаты элементов IA-группы, кроме УзСОз, плавятся без разложения при 800 - 900 С и хорошо растворяются в воде, а карбонаты лития и элементов ПА-группы при нагревании разлагаются до плавления и малорастворимы в воде. [21]
Карбонат лития растворяют в фарфоровой чашке в 20 - 25-процентном растворе хлороводородной кислоты, взятой в некотором недостатке. [22]
Карбонат лития используют в фармакологии как антидепрессивное лекарственное средство. [23]
Карбонат лития Li2CO3 - белый кристаллический порошок, образуется при вливании концентрированного раствора хлорида лития в аммиачный раствор карбоната аммония и нагревании смеси. Более растворим в присутствии солей натрия и калия и еще лучше в присутствии аммонийных солей. Карбонат полностью диссоциирует при нагревании до 780 в токе водорода. [24]
Карбонат лития растворим в разбавленных минеральных и уксусной кислотах и не выпадает в присутствии солей аммония. Следовательно, карбонат аммония не полностью осаждает ионы лития. [25]
Карбонат лития лучше растворим в холодной воде, чем в горячей. Этим иногда пользуются для очистки карбоната. Можно предположить, что в воде, содержащей С02, образуется гидрокарбонат, так же как в случае щелочноземельных металлов. В твердом состоянии гидрокарбонат лития не получен. [26]
Карбонат лития является исходным продуктом для получения большинства других солей лития. [27]
Карбонат лития выпадает в виде белого кристаллического осадка, однако, лишь в тех случаях, когда концентрация в растворе ионов Li и СОд достаточно велика. [28]
Карбонат лития заметно растворим в воде, вследствие чего катионы ли тия осаждаются из раствора неполностью. Поэтому для проведения реак ции используют концентрированные растворы солей лития и раствори мых карбонатов. Реакцию предпочтительно проводить при нагревании, так как растворимость карбоната лития в воде уменьшается с ростом температуры. Карбонат лития растворяется в кислотах. [29]
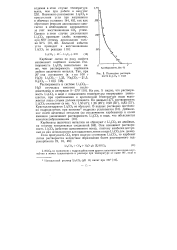 |
Политерма растворимости Li2CO3 в воде. [30] |
Страницы: 1 2 3 4