Водная кислота
Cтраница 2
Безводная кислота образуется после длительного высушивания водной кислоты в эксикаторе над концентрированной серной кислотой. [16]
Гидролиз простых импнов легко протекает в водных кислотах и довольно подробно исследован с помощью кинетических методов. Точный механизм реакции зависит от структуры реагентов и рН раствора. [17]
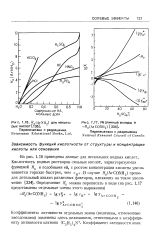 |
Я ( ArNH2 для некого-рых кислот [ Т3б ].| Различные вклады в - Я0 ( АгСОМН2. [18] |
На рис. 1.16 приведены данные для нескольких водных кислот. [19]
Разлагая их в обычных условиях разложения ацеталей водной кислотой, Армстронг получил две а - и ( 3-глюкозы с различным удельным вращением. Явление постепенного изменения вращения в растворах до известного предела носит название муторотации или мультиротации и наблюдается для многих гексоз. Особенно резко оно наблюдается для обыкновенной d - глюкозы. Нагревание и прибавление щелочи ускоряет появление постоянной величины вращения. [20]
Ксантгидриловые эфиры и ксантгидриламины также реагируют с водными кислотами; этим можно воспользоваться для определения положения ксантгидрильной группы в продуктах реакции с ароматическими аминами [258], если реакция проводилась в водном растворе. [21]
Получающаяся маскированная кислота может быть далее выделена обработкой водной кислотой или выделена в виде эфира после катализируемого кислотой эта-нолиза. Преимуществом данного метода являются высокие оптические выходы и возможность регенерации аминоспирта. [22]
ПАУ, азааренов, ароматических аминов и иминов разбавленной водной кислотой ( см. первые 4 строки в табл. II.9) легко отделяются от ПАУ азаарены и другие основные ( имеющие щелочной характер) соединения - амины и имины. [23]
Олефиновая двойная связь в алкеновых кислотах гидратируется под действием водной кислоты или щелочи. Наиболее мягкие условия гидратации состоят в гидроборировании двойной связи с последующей обработкой борорганического соединения пероксидом водорода. [24]
Для извлечения алкалоидов из растительного материала можно использовать экстракцию водными кислотами, затем подщелочить экстракт и извлечь его эфиром или хлороформом или же высушенный и хорошо измельченный материал подщелочить и затем экстрагировать хлороформом. [25]
Шерндал [188, 189] первый заметил, что азулен реагирует с сильными водными кислотами ( такими, как 60 % - ная серная кислота) и может быть таким образом экстрагирован из органического растворителя. Шерндал обратил внимание и на два важных факта, а именно, что реакция азулена с водными кислотами обратима, так что при разбавлении водного слоя азулен возвращается в слой растворителя, и что азулен растворяется в кислом слое, теряя при этом свой характерный синий цвет и окрашивая раствор в желтый, до оранжевого, цвет, причем синий цвет восстанавливается при вытеснении углеводорода разбавлением. [26]
Шерндал [188, 189] первый заметил, что азулеп реагирует с сильными водными кислотами ( такими, как 60 % - ная серная кислота) и может быть таким образом экстрагирован из органического растворителя. Шерндал обратил внимание и на два важных факта, я именно, что реакция азулена с водными кислотами обратима, так что при разбавлении водного слоя азулен возвращается в слой растворителя, и что азулен растворяется в кислом слое, теряя при этом свой характерный синий цвет и окрашивая раствор в желтый, до оранжевого, цвет, причем синий цвет восстанавливается при вытеснении углеводорода разбавлением. [27]
Однако о природе и химических свойствах ионов, образующихся в водной кислоте из Crv или CrIV, известно слишком мало, так как время их жизни слишком коротко для изучения спектральными методами. [28]
Кольтгофф и Латинен 13в описали формы кривых кондуктометри-ческого титрования для ряда водных кислот и оснований различной силы. Эти кривые имеют две характерные особенности. Во-первых, если в результате реакции образуются ионы, обладающие различной подвижностью, или суммарное количество ионов уменьшается ( или увеличивается), на кривой зависимости электропроводности от мольного отношения компонентов в эквивалентной точке наблюдается перегиб. [29]
Если бы все органические соединения можно было изучать как индикаторы в водной кислоте с помощью спектрофотометрии в видимой и ультрафиолетовой областях, то изучение слабых оснований сильно бы упростилось. К сожалению, метод ограничен почти исключительно ароматическими соединениями, хотя некоторые алифатические кетоны, амиды и карбоно-вые кислоты также изучались с помощью спектров поглощения карбонильной группы в близкой ультрафиолетовой области. [30]
Страницы: 1 2 3 4