Концентрация - активная молекула
Cтраница 3
Если скорость какой-либо реакции пропорциональна концентрации активных молекул, то мы можем написать для нее k с [ акт. [31]
При протекании мономолекулярной реакции в равновесии находятся активные и дезактивированные молекулы, а скорость суммарной реакции определяется превращением активной молекулы в продукты реакции. Таким образом, скорость реакции пропорциональна концентрации активных молекул. [32]
Механизм действия катализатора принципиально отличается от влияния температуры на скорость реакции. При повышении температуры скорость реакции возрастает вследствие увеличения концентрации активных молекул за счет поглощения энергии извне. Катализатор источником энергии не является и концентрацию активных молекул изменить не может. Роль катализатора сводится к тому, что в его присутствии энергия активации реакции снижается и, следовательно, скорость реакции возрастает. Так как катализатор снижает энергии активации прямой и обратной реакций на одинаковую величину, то смещения химического равновесия под влиянием катализатора не происходит. [33]
Активные и неактивные молекулы сосуществуют в максвелл-больцмановском равновесии. В этом случае скорость всего процесса в целом будет определяться концентрацией активных молекул, которая может быть вычислена по законам статистического ( максвелл-больцмановского) распределения. [34]
Так как процесс активации эндотермичен, то повышение температуры должно увеличивать концентрацию активных молекул, вследствие чего скорость реакции будет возрастать. [35]
Рассмотрим следующую схему: скорость инициирования пропорциональна Эффективной константе скорости & и и концентрации неактивных макромолекул PJ. Активные молекулы деполимеризу-ются со скоростью, пропорциональной константе скорости деполимеризации & д и концентрации активных молекул RJ. Скорость деполимеризации не зависит от длины полимерной цепи, так как на деструкцию распространяется положение о том, что активность полимерного активного центра не зависит от длины цепи. [36]
Однако активированная соударением молекула может избежать распада, если время ее существования в энергетически заряженном виде достаточно велико по сравнению с интервалами между ее соударениями с менее активными молекулами, что приводит к преждевременной дезактивации. В этом случае сама реакция не может привести к существенным изменениям в статистическом распределении энергии между молекулами и концентрация активных молекул остается постоянной, а скорость реакции подчиняется первому порядку. Вместе с тем анализ молекулярных преобразований из начальных реагирующих молекул в молекулы, представляющие собой конечные продукты реакции, не мог не поставить вопроса о промежуточных состояниях, в которых должны временно находиться реагирующие вещества, еще не успевшие окончательно перегруппировать свои атомы. Некоторое элементарное представление о переходном состоянии может дать следующая простая схема. [37]
Таким образом, увеличение скорости реакции при повышении температуры происходит не в результате увеличения числа столкновений реагирующих молекул, а вследствие роста концентрации активных молекул. Причем соотношение между изменением концентрации активных молекул и изменением температуры таково, что увеличение температуры в арифметической прогрессии вызывает увеличение концентрации активных молекул в геометрической прогрессии. [38]
Таким образом, скорость мономолекулярных реакций зависит от доли активных молекул в реакторе. Последняя в свою очередь зависит от скорости активации и дезактивации молекул. Концентрация активных молекул в данных условиях поддерживается постоянной, соответствующей максвелл-больцмановскому распределению молекул по скорости и энергии и зависит от того, протекает или не протекает реакция. Когда реакция не протекает, число активных молекул пропорционально давлению ( концентрации), так как с изменением давления пропорционально изменяются скорости активации и дезактивации. Если протекает химическая реакция, концентрация активных частиц убывает в результате их распада на продукты реакции Тогда при установившемся процессе постоянство концентрации активных частиц А определяется уело: и м скорость активации равна сумме скоростей дезактивации и реакции. [39]
Концентрация активных молекул зависит от энергии активации реакции и от температуры. При повышении температуры концентрация активных молекул резко возрастает, число столкновений таких молекул увеличивается, что в свою очередь вызывает увеличение скорости реакции. [40]
Скорость реакции пропорциональна концентрации активных молекул. [41]
При термическом распаде CHD2CD2C1 [28] и CHD2CD2Br [25] ( табл. 9.6) первичные внутримолекулярные эффекты при высоком давлении близки по своей величине обсуждавшимся выше межмолекулярным эффектам, но увеличиваются с уменьшением давления. В этом случае и ожидается такое поведение. Оно обязано [28] уменьшению концентрации активных молекул на более высоких энергетических уровнях с уменьшением давления. [42]
Механизм действия катализатора принципиально отличается от влияния температуры на скорость реакции. При повышении температуры скорость реакции возрастает вследствие увеличения концентрации активных молекул за счет поглощения энергии извне. Катализатор источником энергии не является и концентрацию активных молекул изменить не может. Роль катализатора сводится к тому, что в его присутствии энергия активации реакции снижается и, следовательно, скорость реакции возрастает. Так как катализатор снижает энергии активации прямой и обратной реакций на одинаковую величину, то смещения химического равновесия под влиянием катализатора не происходит. [43]
При этом был сделан в некотором смысле шаг назад от Алексеева к Шилову, поскольку роль диффузии не учитывалась. Обозначим через щ концентрацию богатых энергией молекул конечного продукта, а через И2 - концентрацию активных молекул исходного продукта. Обозначим, далее, скорости гибели этих молекул через апи и aZ2u2 соответственно. [44]
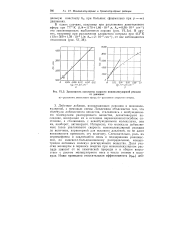 |
Зависимость константы скорости мономолекулярной реакции. [45] |
Страницы: 1 2 3 4