Коэффициент - диссоциация
Cтраница 2
Здесь о - концентрация молекул растворенного вещества; коэффициент диссоциации а-п / п0 есть отношение концентрации ионов к концентрации молекул вещества. [16]
Так как в литературе имеются данные [3, 4] для величин коэффициентов диссоциации только при 20ДС, сделаем расчет для этой температуры. [17]
 |
Объяснение изменения концентрации и линией а имеется че-электролита у электродов тыре пары ионов ( че. [18] |
Входящая в эту формулу концентрация молекул п известна, а коэффициент диссоциации а можно определить из независимых измерений, например из опытов с осмотическим давлением. Поэтому, измеряя удельную электрическую проводимость А электролитов, можно определить сумму подвижностей ионов. [19]
 |
Демонстрация отрицательного температурного коэффициента сопротивления у стекла. [20] |
Входящие в эту формулу величины F и С известны, а коэффициент диссоциации а можно определить из независимых измерений, например из опытов с осмотическим давлением. [21]
 |
Демон страция отрицательного температурного коэффициента сопротивления у стекла. [22] |
Входящие в эту формулу величины F и С известны, а коэффициент диссоциации ос можно определить из независимых измерений, например из опытов с осмотическим давлением. [23]
Это происходит по двум причинам: во-первых, при увеличении температуры увеличивается коэффициент диссоциации а; во-вторых, при нагревании вязкость жидкостей уменьшается и поэтому подвижность ионов увеличивается. [24]
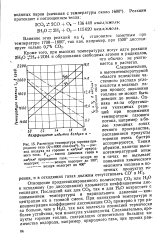 |
Расчетная температура горения природного газа ( Q8000 ккал / нм3. VB - расход воздуха на горение в нж3 / кж3 природного газа. Vot-выход дымовых газов в. [25] |
Отношение продиссоциированного количества СО2 или Н2О к исходному ( до диссоциации) называется коэффициентом диссоциации Последний как для СО2, так и для Н2О возрастает с повышением температуры и парциального давления - концентрации их в газовой смеси. При одинаковой температуре и концентрации коэффициент диссоциации СО2 примерно в три раза больше чем у КО, так как молекула последней термически более устойчива, чем молекула углекислоты. [26]
Зависимость р от концентрации раствора имеет сложный характер, так как при изменении концентрации изменяются также коэффициент диссоциации и подвижности попов. При малых концентрациях а и ( it H) изменяются мало, так что ( I убывает обратно пропорционально С. При дальнейшем увеличении концентрации достигает минимума, а затем возрастает вследствие убывания как коэффициента диссоциации а, так и иод-вижиостей попов. [27]
Зависимость р от концентрации раствора имеет сложный характер, так как при изменении концентрации изменяются также коэффициент диссоциации и подвижности ионов. При малых концентрациях а и ( / i - t - / i) изменяются мало, так что р убывает обратно пропорционально С. При дальнейшем увеличении концентрации р достигает минимума, а затем возрастает вследствие убыванию как коэффициента диссоциации а, так и подвижностей ионов. [28]
Если молекула электролита диссоциирует на два иона, то их валентности одинаковы ( Z), концентрации также одинаковы и равны ая0, где а - коэффициент диссоциации, и0 - концентрация электролита ( стр. [29]
Поскольку мы приняли, что концентрация материально заряженных частиц ( положительных и отрицательных) в электролите одинакова ( С С - Сс (), то полная плотность тока выражается формулой / - Ced ( b - - bJ) E, где d - коэффициент диссоциации. [30]
Страницы: 1 2 3 4