Атом - кислород
Cтраница 2
Атомы кислорода в нитратном ионе имеют неподеленные электронные пары с низкой энергией гибридных орбиталей. [16]
Атом кислорода имеет четыре электрона в 2р - оболочке. Это значит, что два из них могут участвовать в образовании связи. Поскольку а-связь характеризуется более низкой энергией, чем я-связь, следует ожидать, что в молекуле кислорода будет одна ст-связь и одна я-связь. [17]
 |
Молекулярные модели кремневых кислот, соответствующие структурам, изображенным на. [18] |
Атомы кислорода изображены в виде сфер; атомы водорода - в виде черных кружочков. Атомы кремния находятся внутри кислородных тетраэдров и на рисунке не видны. [19]
Атомы кислорода, фтора и неона могут быть, соответственно, двух -, одно - и нульвалентны по числу неспаренных электронов; распаривание остальных электронов энергетически не выгодно. [20]
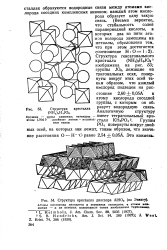 |
Структура кристалла диаспора AlHOj ( по Эвяигу. [21] |
Атомы кислорода находятся в вершинах октаэдров, а атомы ал-миния - в их центрах; водородные свази изображены трубочками. [22]
Атомы кислорода и серы в циклах фурана и тиофена образуют по две кова-лентные связи с углеродными атомами цикла, и каждый из этих гетероатомов сохраняет две неподеленные электронные пары ( см.); атом азота в цикле пиррола образует три ковалентные связи - две с атомами углерода и одну с атомом водорода - и сохраняет одну неподеленную электронную пару. Такие неподеленные электронные пары гетероатомов взаимодействуют с п-электронами атомав углерода ( см.); в результате в пятичленных гетероциклах возникает единое шестиэлектронное облако - секстет обобщенных электронов, в образовании которого принимают участие две пары л-электронов от двух двойных связей и одна неподеленная электронная пара от гетероатома. [23]
Атом кислорода может образовывать также двойные связи за счет рп-ря или рп-йя-связывания. [24]
Атомы кислорода в молекуле Н2О2 связаны друг с другом одной ковалентной связью. Кроме того, каждый атом кислорода имеет с водородом по одной полярной связи. Следовательно, окислительное число атома кислорода равно в данном случае - 1, поскольку одна общая электронная пара оттянута в сторону этого элемента. [25]
 |
Схематическое изображение на плоскости структуры гипотетического соединения А2О3 в а кристаллической и б стеклообразной формах. [26] |
Атом кислорода не может быть связан больше чем с двумя атомами А. [27]
Атом кислорода имеет 6 электронов на внешнем уровне. [28]
Атом кислорода по электроотрицательности уступает только фтору. Фтор не имеет вакантных орбиталей на валентной оболочке, чтобы присоединить все валентные электронные пары кислорода. Поэтому выше трех ковалентность кислороду не свойственна. [29]
 |
Уровни энергии и л. - - я - переход в молекуле анилина.| Уровни энергии и я - - я - переход в молекуле бензальдегида... [30] |
Страницы: 1 2 3 4 5