Свободная электронная пара
Cтраница 3
Иначе говоря, свободная электронная пара в момент своего образования втягивается в молекулу альдегида. Это снижает основность аниона и делает ее сравнимой с основностью основания 1, выравнивая конкуренцию обоих оснований за протон. [31]
При таком угле свободная электронная пара азота ориентирована параллельно я-электронной системе ароматического ядра, что обеспечивает осуществление сопряжения. [32]
В окиси амина прежде свободная электронная пара теперь поделена между азотом и кислородом. Таким образом, атом азота как бы потерял один электрон, а кислород приобрел лишний электрон сверх имевшихся у него шести валентных электронов. Это значит, что в окиси амина атом азота имеет положительный заряд, равный заряду электрона, а атом кислорода - такой же отрицательный заряд. Эти заряды притягиваются друг к другу, подобно разноименным зарядам обычных ионов. Следовательно, возникшая между атомами азота и кислорода ковалентная связь дополняется ионной ( полярной) связью. [33]
При таком угле свободная электронная пара азота ориентирована параллельно л-электронной системе ароматического ядра, что обеспечивает осуществление сопряжения. [34]
В анионе Па свободная электронная пара а-углеродного атома взаимодействует с и-электронами бензольного кольца. Она не локализована на а-углеродном атоме, а смещена по направлению к бензольному кольцу. В результате плотность облака этой электронной пары рассредоточена между - углеродным атомом, двумя орто - и одним пара-углеродным атомом бензольного кольца, которые несут некоторый небольшой отрицательный заряд. В анионе 116 взаимодействие электронной пары - углеродного атома с it - электронами бензольного кольца невозможно. [35]
В анионе Па свободная электронная пара а-углеродного атома взаимодействует с я-электронами бензольного кольца. Она не локализована на а-углеродном атоме, а смещена по направлению к бензольному кольцу. [36]
За счет своей свободной электронной пары кислород присоединяет протон, вся группировка приобретает положительный заряд и связывается ионной связью с анионом хлора. [37]
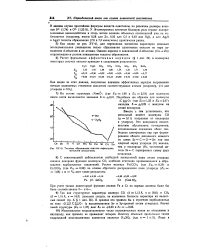 |
Теплоты образования окислов переходных металлов ( ккал / г-экв. [38] |
С относительной лабильностью свободной электронной пары атома углерода связана донорная функция молекулы СО, наиболее отчетливо проявляющаяся в образовании карбонильных соединений. [39]
ОН - имеет свободную электронную пару для образования ковалентной связи и является основанием. [40]
Цианид-ион CN имеет свободную электронную пару, которая оттягивается при комплексообразовании к атому железа ( П), в результате чего возникает с-донорно-акцепторная ( от лиганда к металлу) составляющая координационной связи. Кроме того, атом железа ( П) с / - электронной конфигурацией 3d6 может локировать ( / - электроны на пустую ( разрыхляющую) молекулярную тс-орбиталь цианогруппы, в результате чего возникает п-дативная ( от металла к лиганду) составляющая координационной связи. В итоге обобществления электронов как лиганда ( цианогруппа), так и металла ( железо ( П)) образуется двойная ковалентная полярная координационная связь железо ( П) - цианогруппа. Вследствие всех этих перераспределений электронной плотности в шести координационных связях железо ( П) - цианогруппа положительный заряд на атоме желе-за ( П) уже не равен двум, а отрицательный заряд на цианогруппе также уже не равен минус единице. [41]
ОН - имеет свободную электронную пару, необходимую для образования ковалентной связи с ионом водорода и потому является основанием. [42]
Присоединение азота к свободной электронной паре представляет собой довольно редкую реакцию. [43]
Присоединение протона к свободной электронной паре О, N или S приводит к исчезновению длинноволновой полосы поглощения молекулы, подтверждая тем самым, что несвязывающие электроны п гетероатома принимают участие в процессе возбуждения молекулы. [44]
Реакции присоединения по свободной электронной паре третичных фосфинов идут с сохранением конфигурации. [45]
Страницы: 1 2 3