Полный перенос - электрон
Cтраница 4
Робертсон [237], обсуждая некоторые ароматические молекулярные соединения, заметил, что иногда не может быть никаких сомнений в образовании необычной или устойчивой ковалентной связи между компонентами. Однако, следуя Малликену, он отмечает, что в некоторых случаях возможен механизм общего типа, при котором наблюдается притяжение льюисовских кислот и оснований. Например, в п-ни-троанилине может возникнуть связь между донор-ными электронами бензольного кольца и акцепторными орбитами нитрогруппы. Конечно, сила взаимодействия меняется в зависимости от присутствия ароматических заместителей. При этом возможны все случаи - от полного переноса электронов до незначительного перекрывания орбит с резонансом между несвязанной структурой и структурой с переносом зарядов или ионной структурой. [46]
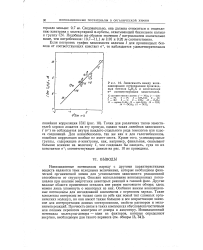 |
Зависимость между ионизационными потенциалами производных бензола CgHgX и константами а соответствующих заместителей. [47] |
Ионизационные потенциалы наряду с другими характеристиками веществ являются теми исходными величинами, которые необходимы физической органической химии для установления зависимости реакционной способности от структуры. Описано использование ионизационных потенциалов при анализе энергетики некоторых реакций в газовой фазе. Особенно важны ионизационные потенциалы для исследований комплексов с переносом заряда. Такие комплексы интересны не только сами по себе как новый тип сложных органических молекул, но они имеют также большое и все возрастающее значение для интерпретации данных спектроскопии, свойств растворов и механизмов реакцию Прочность связи в таких комплексах обусловлена частичным или полным переносом электрона от донора к акцептору. [48]
Одним из важных разделов теоретической химии является учение о химической связи. Ковалентная связь осуществляется общей электронной парой, облако которой по-разному может распределяться в пространстве относительно ядер атомов. Если электронное облако располагается симметрично между ядрами обоих атомов, то такая связь является неполярной ковалентной связью. Если электронное облако смещается в сторону более электроотрицательного атома, то происходит поляризация связи. Такая ковалентная связь называется полярной. Другой разновидностью химической связи является ионная связь, которую следует рассматривать как результат полного переноса электрона от одного атома к другому. Здесь допускается, что связь обусловлена силами электростатического притяжения между частицами противоположного заряда. [49]
Взаимодействие электронодефицитных органических соединений с нуклеофилами приковывает внимание химиков уже с конца XIX века. Такое внимание частично объясняется появляющейся иногда в реакциях такого типа интенсивной окраской раствор а, по которой можно определить степень и характер взаимодействия. Установлено, что некоторые виды взаимодействия зависят от структуры реагента и природы применяемого растворителя. Обычно взаимодействие состоит в переносе заряда от нуклеофила к ароматическому соединению, а его тип характеризуется степенью и способом такого переноса. При этом могут образоваться донорно-акцепторные ( л) комплексы, в которых связь очень слаба и дело-кализована. Более сильное взаимодействие может наблюдаться в ковалентно связанных о-комплексах. Полный перенос электрона осуществляется в ион-радикалах. Все эти взаимодействия могут осложняться одновременным или последующим замещением в органическом соединении. Данный обзор посвящен взаимодействиям, приводящим к стабильным анионным о-комплексам, а также описанию структурных и химических характеристик этих комплексов. [50]
Томсон [7] опубликовал работу, явившуюся первой широкой попыткой согласовать химические свойства с электронной структурой. Поскольку его теория оказалась в значительной степени ошибочной, мы не будем обсуждать ее подробно, а лишь отметим, что Дж. Томсон считал валентность результатом стремления атомов достигнуть электронной устойчивости. Они достигают этого путем переноса корпускул от одного атома к другому, приобретая при этом отрицательные или положительные заряды, играющие роль валентных сил. Томсон, однако, ошибался, полагая, что при образовании химических связей всегда имеет место полный перенос электронов от одного атома к другому. [51]
Для перекиси водорода наиболее существенным фактором является концентрация отрицательного заряда в кислороде. Она может быть выражена различным образом в зависимости от точки зрения того или иного автора или предлагаемого механизма реакции. Необходимо отметить, что электро-отрицателыюсть-относительное понятие, пока еще не поддающееся точному определению. Например, изолированный атом ( или группа) рассматривается как частица, обладающая известной электроотрицательностыо. Однако в том случае, когда происходит какая-либо реакция или молекулярное взаимодействие, относительная величина этой электроотрицателыюсти изменяется. Как подчеркивает Сэндерсон [26], логично предполагать, что при образовании химической связи средняя электронная плотность взаимодействующих атомов изменяется в молекуле таким образом, чтобы придать им одинаковую электроотрицателыюсть. Такой процесс ограничивается возможной степенью переноса электронов; при комбинировании группы, имеющей ВЫСОКУЮ электро-отрицателыюсть, с другой группой, обладающей низкой электроотрицателыю-стыо, может оказаться, что даже полный перенос электронов не в состоянии обеспечить равенство; например, перекиспый ион ОТ сохраняет электроотрицателыюсть в самых различных комбинациях. [52]
Страницы: 1 2 3 4