Переход - ион - металл
Cтраница 3
Если же металл помещен в раствор соли, то переходу ионов металла в раствор будут противодействовать уже имеющиеся в растворе такие же ионы. [31]
В обычных условиях образование электрофоретичес-кого осадка на аноде сопровождается переходом ионов металла в ванну и в осадок. [33]
При анодной поляризации металлических электродов возможно их растворение с переходом ионов металлов в раствор. [34]
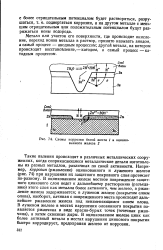 |
Схемы коррозии белой жести 1 и оцинкованного железа 2. [35] |
Металл или участок его поверхности, где происходит окисление, переход ионов металла в раствор, принято называть анодом, а самый процесс - анодным процессом; другой металл, на котором происходит восстановление - катодом, а самый процесс-катодным процессом. [36]
Сначала, как обычно, ток возрастает в связи с переходом ионов металла в раствор, однако при потенциале пассивации картина резко меняется, и ток падает до очень низкого значения, которое не увеличивается до тех пор, пока не начнется какая-нибудь другая анодная реакция. [37]
Электролитическая коррозия принципиально является электрохимическим процессом, который заключается в переходе иона металла из металлической фазы в электролит или в фазу продукта реакции. Поэтому скорость коррозионного процесса определяется законами электрохимической кинетики. Таким образом, управление процессами коррозии предполагает знание кинетики электродных процессов. [38]
Теперь очевидно, что в пределах каждого из электродов, кроме перехода ионов металла в раствор и их гидратации; необходимо учитывать еще процесс выхода электронов из куска металла, образующего электрод. [39]
Перенапряжение процесса ионизации металла, когда выход электронов происходит быстрее, чем переход ионов металла в раствор. [40]
Процессы анодного растворения металлов в большинстве случаев являются более сложными, чем простой электрохимический переход иона металла из кристаллической решетки в раствор: для растворения требуется не только сольватация иона, но в ряде случаев также предварительная химическая адсорбция аниона ( С1 -, ОН -) из раствора с образованием переходного, а затем устойчивого комплекса. [41]
Во втором случае появление положительного заряда на поверхности металла будет замедлять реакцию перехода ионов металла на поверхность и ускорять обратную реакцию ионизации металла до тех пор, пока скорости обоих процессов не станут равными друг другу. [42]
Электрохимическая коррозия металла в электролите сопровождается двумя сопряженными процессами: 1) переходом ионов металла в электролит с образованием гидратированных ионов и 2) разряд этих ионов с выделением на поверхности металла нейтральных атомов. Первый процесс называется анодным, второй - катодным. [43]
Заслуживают внимания два механизма точения указанных процессов: электронный механизм и механизм, предполагающий переход ионов металла в раствор и их восстановление ( или окисление) на токоотводящих компонентах электрода. Возможность осуществления того или иного механизма определяется растворимостью окислов или солей, а также их электронной проводимостью. Например, электронный механизм получил свое развитие применительно к восстановлению окислов Ni. Восстановление плохопроводящих РЬ804 [15] и окислов железа [16], кадмия [17] и цинка происходит по второму механизму. [44]
Из ( 23.1 - 23.5) видно, что процесс разрушения металла сопровождается переходом ионов металла в электролит с образованием растворимых или слаборастворимых в воде компонентов. [45]
Страницы: 1 2 3 4
