Коррозионное электрохимическое поведение
Cтраница 2
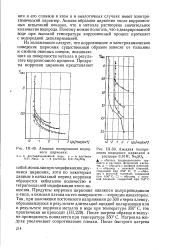 |
Анодная поляризация иодид-ного циркония.| Анодная поляризация иодидного циркония в растворе 0 01Н. Na2SO4. [16] |
Из изложенного следует, что коррозионное и электрохимическое поведение циркония существенным образом зависит от толщины и свойств окисных пленок, возникающих на поверхности металла в результате коррозионного процесса. [17]
Данные о влиянии гидродинамических факторов на коррозионное и электрохимическое поведение сталей и сплавов в пассивном состоянии представляются весьма важными при выборе коррозионно-стойких конструкционных материалов и определении оптимальных параметров анодной защиты. [18]
Исследовано влияние концентрации ионов хлора на коррозионное и электрохимическое поведение углеродистой стали. Обнаружено три области растворения стали в зависимости от концентрация хлорида. Высказаны предложения о механизме растворения стали в исследованной системе. [19]
 |
Зависимость скорости коррозии Ti и его сплавов с Сг от потенциала в 5 % - ном растворе H2S04 при 60 С. [20] |
По-видимому, влияние добавки хрома на коррозионное и электрохимическое поведение сплавов системы титан-хром в растворах фосфорной кислоты будет менее сильным, чем в растворах серной и соляной кислот. [21]
Исследования, результаты которых приводятся ниже, касаются коррозионного и электрохимического поведения сплавов системы титан - молибден, а также нелегированных титана [32-34] и молибдена в растворах едкого кали при концентрациях от 40 до 50 % и температурах 100 - 150 С. На рис. 8 представлена зависимость скорости коррозии титана от потенциала, полученная в 50 % - ном растворе едкого кали. На потенциостатичееких кривых 1 и 2 имеются явно выраженные области активного растворения титана с максимумами при потенциале пассивации, равном - 0 7 в. Повышение концентрации щелочи увеличивает скорость коррозии титана. По сравнению с растворами кислот в щелочных растворах активная область растворения титана смещена к более отрицательным значениям потенциала. [22]
В работе В. В. Андреевой с сотрудниками обобщены данные о коррозионном и электрохимическом поведении новых сплавов на основе редких и тугоплавких элементов. В качестве примеров, иллюстрирующих возможности использования в технике сплавов на основе редких элементов, могут служить сплавы системы титан-молибден, обнаруживающие высокую стойкость в неокислительных кислотах и сплавы системы ниобий-тантал ( 30 - 50 %), приближающиеся по своей стойкости в серной кислоте ( 120 - 140 С) к стойкости чистого тантала. В статье также описывается электрохимическое поведение подобных сплавов в широком диапазоне потенциалов. [23]
Таким образом, состав среды имеет значительное влияние на коррозионное и электрохимическое поведение сплавов на основе титана с добавками хрома. [24]
 |
Схема установки для электрохимических исследований. [25] |
На рис. 60 приводится общий вид установки для исследования коррозионного и электрохимического поведения металлов под тонкими пленками электролитов. [26]
Показано, что экспериментальные данные по влиянию галоидных ионов на коррозионное и электрохимическое поведение стали 1Х18Н9Т при сернокислотном травлении согласуются с хемосорб-ционной теорией. [27]
Настоящее исследование посвящено изучению влияния различных компонентов сплава МАИ на его коррозионное и электрохимическое поведение. [28]
Полученные результаты указывают на определяющее влияние структуры сплава 4207 на его коррозионное и электрохимическое поведение. [29]
В данной работе было изучено влияние молибдена, вольфрама и ванадия на коррозионное и электрохимическое поведение хромо-никелевой медистой стали в растворах серной кислоты при повышенных температурах. [30]
Страницы: 1 2 3 4