Понятие - электроотрицательность
Cтраница 2
Понятие электроотрицательности известно в химии более 150 лет, и с развитием учения о строении атомов и химической связи получило электронную интерпретацию. [16]
Количественно понятие электроотрицательности очень простое: если в связи А - В электронное облако связи смещено в сторрну А, то А более электроотрицателен, чем В. [17]
В понятие электроотрицательности элементов включается совокупность их свойств, связанных с поведением внешних электронов в атоме. Электроотрицательность характеризуется как способность атома в молекуле притягивать электроны и может определять способность к образованию соединения с другими элементами, в том числе и в живом организме. В то же время она отличается от электронного сродства свободных атомов, хотя и изменяется симбатно с ним. Значение электроотрицательности в периодической системе элементов растет слева направо и снизу вверх, противоположно тому как увеличиваются атомные радиусы. Чем больше значение электроотрицательности ( табл. 3), тем труднее отделить электрон от атома. Этот показатель повышается с увеличением валентности металла в соединении. [18]
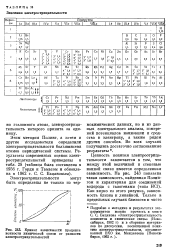 |
Кривая зависимости процента ионности химической связи от разности электроотрицательностей. [19] |
Ценность понятия электроотрицательности заключается в том, что между этой величиной и степенью ионной связи имеется определенная зависимость. Как видно из этого рисунка, зависимость близка к линейной. [20]
Определение понятия электроотрицательности элемента как меры сродства атома к валентному электрону указывает на возможность его использования для нахождения асимметрии в распределении электрических зарядов химической связи. [21]
Под понятием электроотрицательности подразумевается сродство к электрону атомов химических элементов в соединении. При равенстве электроотрицательностей двух атомов, дающих связь, получается кова-лентная связь. В чистом виде она имеет место в некоторых простых веществах, например в молекулах галогенов. Если соединяются атомы, имеющие разную электроотрицательность, то увеличение такого различия сопровождается повышением полярности связи. [22]
Между тем понятие электроотрицательности играет очень большую роль в современной теоретической химии и, следовательно, нигилистический отказ от него оставил бы брешь, которую необходимо было бы, при конструктивном подходе, заменить другим понятием. Задача исторического анализа учения об электроотрицательности, с этой точки зрения, заключается в том, чтобы выяснить содержание понятий, которые разными авторами предлагались в качестве заменителей понятия электроотрицательности. [23]
При этом само понятие электроотрицательности становится лишним, поскольку каждая орбиталь количественно характеризуется не электроотрицательностью, а ее энергетическим уровнем ( потенциалом ионизации /) и энергией отталкивания ( R) между расположенными на ней электронами при заселенности, равной двум. [24]
С тех пор понятие электроотрицательности было значительно развито на эмпирической основе и позволяет ввести легко запоминающуюся шкалу для установления корреляции между различными свойствами связей. [25]
Проследим дальнейшую судьбу понятия электроотрицательности во второй половине XIX в. [26]
В течение многих лет понятие электроотрицательности служило качественной мерой относительной способности атомов в молекуле притягивать к себе электроны. Это понятие обычно связывалось с грубым делением элементов на металлы и неметаллы: с ослаблением металлических свойств элементов их электроотрицательность возрастает. Такое же объяснение применяют и для ряда активностей металлов. Элемент в начале ряда, наиболее активный металл, рассматривают как наименее электроотрицательный и, следовательно, наиболее электроположительный. С другой стороны, элементы конца ряда имеют соответственно большую электроотрицательность. [27]
 |
Сродство к электрону эв для некоторых элементов. [28] |
В течение многих лет понятие электроотрицательности служило качественной мерой относительной способности атомов в моле куле притягивать к себе электроны. [29]
В течение многих лет понятие электроотрицательности служило качественной мерой относительной способности атомов в молекуле притягивать к себе электроны. Это понятие обычно связывалось с грубым делением элементов на металлы и неметаллы: с ослаблением металлических свойств элементов их электроотрицательность возрастает. Такое же объяснение применяют и для ряда активностей металлов. Элемент в начале ряда, наиболее активный металл, рассматривают как наименее электроотрицательный и, следовательно, наиболее электроположительный. С другой стороны, элементы конца ряда имеют соответственно большую электроотрицательность. [30]
Страницы: 1 2 3 4