Разложение - перекисное соединение
Cтраница 2
 |
Разложение гидроперекиси кумола при 140 С в смеси с кумолом. [16] |
Однако из наших опытов видно, что в ходе реакции гидроокись натрия расходуется по какой-то побочной реакции с возникновением соединения, не способного взаимодействовать с гидроперекисью кумола с образованием натрий-кумилперекиси, и, следовательно, не способного далее катализировать разложение исходного перекисного соединения. Но это малоактивное соединение натрия тем не менее оказывается способным нейтрализовать кислоту, образующуюся при разложении гидроперекиси кумола, что, в свою очередь приводит к полному торможению ее кислотного разложения. [17]
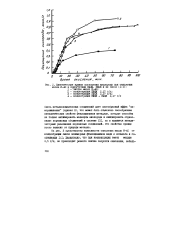 |
Кинетические кривые поглощения кислорода при окислении масла И-40 в присутствии ПФЦМ, ПФЦК и их смеси. [18] |
Смесь металлокомплексных соединений дает своеобразный эффек замораживания ( кривая 3), что может быть объяснено своеобразием каталитических свойств фталоцианинов металлов, которые способны не только активировать молекулы кислорода и инициировать образование перекисных соединений в системе [2], но и являются катализаторами разложения перекисных соединений. Это свойство прежде всего зависит от природы металла. [19]
Сопоставление данных Поп, Дикстра и Эдгара с полученными в 1933 - 1937 гг. в нашей лаборатории результатами исследования окисления н - и изогептанов, а также циклоалкановых углеводородов в паровой фазе [10, 11, 12], показывает, что применение предосторожностей, уменьшающих вероятность разложения промежуточных перекисных соединений ( проведение окислительного процесса И накопления перекисей в кварцевой аппаратуре, замораживание реакции путем резкого охлаждения реакционной смеси по выходе из реакционной трубки, использование метода фракционированной конденсации продуктов окисления), позволяет выделить из продуктов парофазного окисления насыщенных углеводородов до 30 % перекисей от веса прореагировавшего углеводорода. [20]
 |
Результаты окисления фенантрена различной степени чистоты. [21] |
Для озонолиза фенантрена в уксусной кислоте Н. Д. Русьяновой была предложена следующая схема: а) получение озонида фенантрена при 20 С без катализатора ( расход озона 1 моль); б) разложение озонида при 80 С в присутствии 2 % ацетата никеля; в) окисление альдегидов при 20 С; г) разложение перекисных соединений при 50 С. При этом требуется 1 6 - 1 8 моль озона на 1 моль фенантрена. [22]
Характерными особенностями органических перекисей являются их нестабильность и высокая реакционная способность, которые и обусловливают повышенную опасность работы с ними. Разложение перекисных соединений при нагревании, а также под воздействием ионов металлов переменной валентности, аминов, сернистых и других соединений может происходить как при синтезе, так и при применении. [23]
Глазивец [51]: вещество состава С5Н8, выделенное из продуктов пиролитического разложения терпентина, взрывалось при повышении температуры. Несомненно, Глазивец имел дело с образованием и разложением перекисного соединения изопрена. [24]
Из данных табл. 2 видно также, что хотя степень окисления моногидроперекисей достигала 0 25 - 0 35, однако выход дигидро-перекисей при этом не превышал 12 % от рассчитанного. Это указывает, что одновременно с образованием дигидроперекисей идет разложение перекисных соединений. При введении окиси кальция в реакционную смесь скорость окисления и выход гидроперекисей повышаются. [25]
В какой степени окисления находится хром в соединении, получен-ном после разложения перекисного соединения. [26]
В настоящее время проводится исследование каталитической волны перекиси водорода, образующейся в присутствии вольфрамат-иона, с целью аналитического применения ее для определения малых количеств вольфрама. Обнаруженный Кольтгофом и Перри [20] каталитический эффект вольфрама на восстановление Н2О2 качественно подтверждается, однако получение воспроизводимых количественных значений каталитического тока затрудняется вследствие параллельно протекающих процессов диспропорцио-нирования продуктов электродной реакции, разложения перекисных соединений и других процессов. В связи с этим изучено влияние различных факторов ( концентрации Н2О2 и WO -, природы электролита, рН раствора, температуры, давления столба ртути над капилляром и др.) на величину каталитического тока Н202 в присутствии вольфрамат-иона. Обнаружен большой температурный коэффициент этой реакции, а также влияние времени контакта реагирующих компонентов на величину тока. [27]
В настоящее время проводится исследование каталитической волны перекиси водорода, образующейся в присутствии вольфрамат-иона, с целью аналитического применения ее для определения малых количеств вольфрама. Обнаруженный Кольтгофом и Перри [20] каталитический эффект вольфрама на восстановление Н2О2 качественно подтверждается, однако получение воспроизводимых количественных значений каталитического тока затрудняется вследствие параллельно протекающих процессов диспропорцио-нирования продуктов электродной реакции, разложения перекисных соединений и других процессов. В связи с этим изучено влияние различных факторов ( концентрации НЙО2 и WO2, природы электролита, рН раствора, температуры, давления столба ртути над капилляром и др.) на величину каталитического тока Н2О2 в присутствии вольфрамат-иона. Обнаружен большой температурный коэффициент этой реакции, а также влияние времени контакта реагирующих компонентов на величину тока. [28]
Страницы: 1 2