Пространственное распределение - электрон
Cтраница 3
Рассматривая только геометрию дифракционной картины, можно, принимать условно, что рассеивают или отражают не атомы ( и не-электроны атомов), а узлы решетки или узловые сетки решетки. Очевидно также, что направления дифрагированных кристаллом лучей, регулируются условиями Лауэ ( или уравнением Брегга-Вульфа), независимо от того, являются ли атомы точечными или учитывается пространственное распределение электронов, находятся ли атомы в по -, кое или совершают тепловые колебания, происходит или не происхо-дит ослабление первичного пучка при прохождении сквозь кристалл вследствие поглощения. [31]
 |
Схема электронного распределения по МО открытых оболочек в ограни. [32] |
МО), что иллюстрирует рис. 4.5. Но число а-электронов в нашем случае больше числа - электронов, поэтому электроны с а-спином в дважды заполненных МО будут испытывать большее отталкивание от неспаренных а-электронов, чем электроны с / J-спином в дважды заполненной МО. Задавать одну и ту же пространственную часть для а - и - электронов - значит налагать не вполне оправданное ограничение на волновую функцию, а следовательно, и на пространственное распределение электронов. [33]
Это например, задачи о равновесном профиле электронов в атомной ячейке [123] и на границе проводника [162], о профиле плазмы вблизи заряженной стенки, о равновесном профиле свободных зарядов вблизи макроскопической частицы конденсированной дисперсной фазы ( пылевая плазма), о пространственном распределении электронов и ионов в сильноточном разряде ( Z-пинче) [163] и многие другие. Общее для всех этих задач - представление о локальном термодинамическом равновесии ( ЛТР) и, соответственно, локальном уравнении состояния ( УPC), связывающем локальные температуру, давление и плотность с локальными химическими потенциалами всех сортов частиц. Хорошо известны два варианта такого приближения: приближение Пуассона Больцмана для невырожденных частиц и приближение Томаса Ферми для вырожденных. [34]
 |
Таблиц 1. Библиографий 17. [35] |
Полученные результаты использованы для вычисления структурных амплитуд для кубических объемно - и гранецентрированных решеток. Показано, что у переходных металлов анизотропия рассеяния рентгеновых лучей и электронов должна наблюдаться как для монокристалличе-скнх, так и для поликристаллнческих тел. Изменения относительных интенсивностей рентгенограмм, обусловленные отклонением от центральной симметрии в пространственном распределении электронов, могут достигать 20 - 40 % для элементов второго периода и 4 - 5 % для переходных металлов. [36]
Если электрон движется по такой замкнутой орбите, что протяженность пути за один оборот равна целому числу длин волн, то орбита является квантованной и электрон не приобретает и не теряет энергии. Волновая функция квантованной орбиты представляет собой стоячую волну, для которой вероятность нахождения электрона в данной точке не меняется со временем. Нетрудно представить себе, что концепция постоянства вероятности для точки пространства эквивалентна тому, что любая энергия, способная изменить пространственное распределение электрона, не приобретается и не теряется им. [37]
Но число а-электронов в нашем случае больше числа р-электронов, поэтому электроны с а-спином в дважды заполненных МО будут испытывать большее отталкивание от неспаренных а-электронов, чем электроны с р-спином в дважды заполненной МО. Этот эффект должен быть отражен определенными различиями в пространственных функциях а - и р-электронов в заполненных МО. Задавать одну и ту же пространственную часть для а - и р-электронов, значит налагать не вполне оправданное ограничение на волновую функцию, а следовательно, и на пространственное распределение электронов. [38]
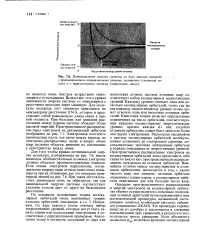 |
Потенциальная энергия системы из двух атомов водорода с противоположно направленными спинами электронов ( сплошная линия и с параллельными спинами ( штриховая линия. [39] |
Каждому уровню отвечает одна или несколько молекулярных орбиталей, точно так же как каждому энергетическому уровню атома может отвечать одна или несколько атомных орбиталей. Квантовая теория налагает определенные ограничения на число орбиталей, соответствующих каждому молекулярному энергетическому уровню, причем каждая из них, подобно атомным орбиталям, может быть занята не более чем двумя электронами. Располагая сведениями о системе молекулярных орбиталей молекулы, можно установить ее электронное строение, последовательно заполняя электронами орбитали в порядке повышения их энергетических уровней. Пространственное распределение электронов на молекулярных орбиталях легко представить себе также по аналогии с пространственным распределением электронов на атомных орбиталях. Важнейшее отличие между молекулярными и атомными орбиталями заключается в том, с каким числом ядер они связаны: атомные орбитали ограничены одним ядром, а молекулярные орбитали охватывают два или большее число ядер. Эта процедура хорошо известна из алгебры и заключается в сложении или вычитании двух уравнений, в результате чего получается третье уравнение. [40]
Это схематически показано на рис. 15.6. Спектр с частотами vKOJ, Bpau, соответствующими переходу с одного колебательного уровня на другой, состоит из группы очень близких линий, определяемых различными сопутствующими вращательными переходами. В видимой и ультрафиолетовой областях спектра энергии фотонов достаточно для осуществления переходов молекулы между различными электронными энергетическими уровнями. Каждому такому уровню соответствует определенное пространственное распределение электронов, принадлежащих атомам, составляющим молекулы, или, как говорят, определенная конфигурация электронов, обладающая некоторой дискретной энергией. Переходы между такими электронно-колебательными уровнями приводят к возникновению электронно-колебательного спектра молекулы ( рис. 15.7), характеризуемого частотой УЭЛ-КОЛ отдельной линии. [41]
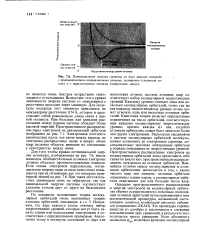 |
Потенциальная энергия системы из двух атомов водорода с противоположно направленными спинами электронов ( сплошная линия и с параллельными спинами ( штриховая линия. [42] |
Каждому уровню отвечает одна или несколько молекулярных орбиталей, точно так же как каждому энергетическому уровню атома может отвечать одна или несколько атомных орбиталей. Квантовая теория налагает определенные ограничения на число орбиталей, соответствующих каждому молекулярному энергетическому уровню, причем каждая из них, подобно атомным орбиталям, может быть занята не более чем двумя электронами. Располагая сведениями о системе молекулярных орбиталей молекулы, можно установить ее электронное строение, последовательно заполняя электронами орбитали в порядке повышения их энергетических уровней. Пространственное распределение электронов на молекулярных орбиталях легко представить себе также по аналогии с пространственным распределением электронов на атомных орбиталях. Важнейшее отличие между молекулярными и атомными орбиталями заключается в том, с каким числом ядер они связаны: атомные орбитали ограничены одним ядром, а молекулярные орбитали охватывают два или большее число ядер. Эта процедура хорошо известна из алгебры и заключается в сложении или вычитании двух уравнений, в результате чего получается третье уравнение. [43]
Прежде чем принять такое объяснение, следует поинтересоваться, имеет ли оно обычный химический смысл. Когда химик интересуется распределением электронов вблизи ядер, он почти всегда имеет в виду энергию системы или свойства, определяемые энергией. Распределение электронной плотности интересует его в той мере, в какой оно определяется свойствами, зависящими от обратной величины первой степени расстояния Q от ядра. Но химический сдвиг протонного магнитного резонанса определяется магнитной экранировкой, вызываемой электронным окружением, зависимость которой от пространственного распределения электронов является значительно более сложной. Возможно, что уменьшение экранировки, которое выводится из сдвига сигнала Н - связи к более низким полям, не означает, что протон чувствует влияние меньшего числа электронов в энергетическом смысле. [44]
Вероятность одновременного нахождения неспаренных электронов двух орбиталей в одной и той же точке пространства равна нулю, но она имеет вполне определенное значение для спаренных между собой электронов двух орбиталей. Электроны в триплетном состоянии стремятся быть друг от друга на большем расстоянии, чем электроны в синглетном состоянии. Триплетные состояния можно описывать как бирадикальные состояния, однако это понятие недостаточно наглядно и не имеет общего характера. Пространственное распределение электронов в возбужденном синглетном состоянии может быть таким, что молекулу в этом состоянии также можно рассматривать как бирадикал. С другой стороны, можно представить себе триплетные состояния, которые по своей природе вовсе не являются бирадикалами, например триплетные состояния длинных сопряженных систем, в которых возбужденный электрон размазан по всей молекулярной системе. [45]
Страницы: 1 2 3 4