Термохимический расчет
Cтраница 2
Термохимические расчеты с использованием табличных данных значительно упростились. [16]
 |
Схема процессов. [17] |
Термохимические расчеты основаны на законе Гесса и следствии из него. [18]
Термохимические расчеты основаны на двух законах тер - Мохимии, вытекающих из закона сохранения энергии. [19]
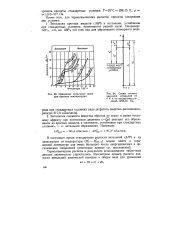 |
Изменение энтальпии газов при высоких температурах.| Схема отсчета значений энтальпий от О К и от стандартных условий ( 298 15 К. [20] |
Термохимические расчеты в результате использования табличных данных значительно упростились. [21]
Термохимические расчеты, основанные на законе Гесса, следует выполнять с помощью термохимических уравнений, представляющих собой стехиометри-ческие уравнения химических реакций, дополненные необходимыми сведениями о состоянии реагирующих и образующихся веществ, а также указанием тепловых эффектов. [22]
 |
Стандартные теплоты фазовых переходов некоторых веществ. [23] |
Термохимические расчеты для реакций в растворах целесообразно проводить не по теплотам образования молекул, а по тепло-там образования ионов. Однако измерить теплоты образования для отдельных ионов невозможно, так как ионам одного знака всегда сопутствуют ионы противоположного знака. [24]
Термохимические расчеты проводят, используя энтальпии ( теплоты) образования веществ. Под энтальпией образования понимают тепловой эффект реакции образования 1 моль вещества из простых. [25]
Термохимические расчеты удобно производить, руководствуясь следующим выводом, вытекающим из закона Гесса: тепловой эффект химической реакции равняется сумме теплот образования получающихся веществ без суммы теплот образования вступающих в реакцию веществ. [26]
 |
Стандартные теплоты фазовых переходов некоторых веществ. [27] |
Термохимические расчеты для реакций в растворах целесообразно проводить не по теплотам образования молекул, а по тепло-там образования ионов. Однако измерить теплоты образования для отдельных ионов невозможно, так как ионам одного знака всегда сопутствуют ионы противоположного знака. [28]
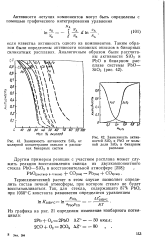 |
Зависимость активности SiO2 от.| Зависимость активностей SiO2 и РЬО от мольной доли SiC2 в бинарном расплаве. [29] |
Термохимический расчет в этом случае позволяет определить состав печной атмосферы, при котором стекло не будет восстанавливаться. [30]
Страницы: 1 2 3 4 5