Термохимический расчет
Cтраница 3
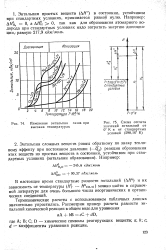 |
Изменение энтальпии газов при высоких температурах.| Схема отсчета. [31] |
Термохимические расчеты с использованием табличных данных значительно упростились. [32]
Термохимические расчеты процесса конверсии с учетом реальных показателей, полученных в эксперименте, выполненные по методике, приведенной в работе f8j, показали, что потери тепла при использовании опытно-промышленного реактора незначительны. [33]
Проведенные ориентировочные термохимические расчеты дают указание на то, что в трехкомпонентной системе As - Ge - Se с большой областью стеклообразования может быть несколько участков, различающихся по содержанию структурных единиц, а следовательно, и по физико-химическим свойствам. Могут быть участки, где преобладают структуры GeSe4 / 2 или AsSes / 2, и участки, где структура определяется в основном связями селенового типа. При соизмеримом содержании тетраэдрических GeSe4 / 2 и тригональных AsSea / 2 в стекле нарушается валентная координационная периодичность, что должно служить стерической помехой к образованию однородной атом-но-дисперсной смеси структурных узлов GeSe4 / 2 и AsSes / 2 и может повлечь за собой химическую микронеоднородность строения стекла путем коллоидально-дисперсного дифференцирования его по типу структурных узлов. При этом на границах раздела микрофаз ( AsSes / 2) m и ( GeSe4 / 2) n, вследствие пространственной несогласованности периодов валентных связей, некоторая часть валентных электронов должна оставаться неспаренной, и создаются тупики и ловушки для носителей тока, ограничивающие сквозную проводимость. [34]
Согласно термохимическим расчетам ( см. табл. 39) для 1 3-диолефинов строения - СН2СН eeCHCHCHCH2 - реакции замещения и присоединения равновероятны. [35]
Многие термохимические расчеты очень упрощаются, если производить их, пользуясь следующим положением, вьггекающим из закона Гесса. [36]
Все термохимические расчеты основаны на двух законах термохимии. [37]
Основой термохимических расчетов служит закон Г. И. Гесса: тепловой эффект химической реакции не зависит от ее отдельных стадий, а зависит только от состояния исходных веществ и продуктов реакции. [38]
Для термохимических расчетов необходимо, чтобы все теплоты реакций были отнесены к одинаковым условиям. Иначе их значения будут не сопоставимы. Это обстоятельство обусловлено тем, что теплота химической реакции зависит от температуры и в меньшей степени от давления. Обычно теплоты химических реакций приводят к стандартным условиям. Для индивидуальных твердых веществ и жидкостей в качестве стандартного принимают состояние их при 1 атм и данной температуре. Для индивидуальных газов в качестве стандартного принимают их состояние в виде гипотетического идеального газа, летучесть которого равна единице при данной температуре. Свойства индивидуальных газов при 1 атм не слишком отличаются от свойств их в стандартных условиях; в расчетах, не требующих высокой точности, этим различием обычно пренебрегают. Следует обращать внимание на то, что для газовой химической реакции, проводимой в стандартных условиях, не общее давление равно 1 атм, а парциальное давление каждого из газообразных компонентов реакции. [39]
Для термохимических расчетов необходимо все теплоты относить к одинаковым условиям - изобарным или изохорным. [40]
Для термохимических расчетов важна энтальпия образования соединений. Энтальпией образования вещества называют энтальпию процесса образования этого вещества из простых веществ при данной температуре. [41]
 |
К понятию стандартный тепловой эффект. [42] |
Для термохимических расчетов необходимо, чтобы все тепловые эффекты были отнесены к одинаковым условиям. В противном случае их значения будут не сопоставимы и алгебраическое суммирование станет невозможным. [43]
Для термохимических расчетов в производстве серной кислоты необходимо иметь данные о теплоте образования серной кислоты, теплоте разбавления и смешивания кислот, теплоемкости, теплоте испарения воды, теплопроводности, вязкости и др. Объем учебника не позволяет подробно остановиться на этих свойствах серной кислоты, поэтому ниже приводятся только самые общие сведения. [44]
Для термохимических расчетов в металлургии, особенно для вычисления констант равновесия, требуется знание термодинамических величин и давления насыщенного пара веществ, участвующих в реакции. [45]
Страницы: 1 2 3 4 5