Скорость
Cтраница 2
Скорость этой реакции вследствие ее бимолекулярного характера значительно понижается при уменьшении концентрации катализатора и в некоторых случаях может даже ограничивать скорость всего процесса в целом. Именно реакцией 2-го порядка по катализатору, ограничивающей в этих условиях высоту волны, объясняется наблюдаемое иногда [733, 747, 750] более быстрое, по сравнению с нарастанием концентрации катализатора, повышение предельного каталитического тока. [16]
 |
Схема пламени. [17] |
Скорость, с которой распространяется зона реакции, определяется скоростями процессов, ответственных за химическое превращение исходных реагентов. Если предполагать, что это достигается только передачей тепла, то скорость инициирования будет функцией теплопроводности исходных реагентов. Однако реакции во многих пламенах происходят по цепному механизму с участием свободных радикалов, обычно содержащих атомы водорода; следовательно, инициирование может быть вызвано диффузией свободных радикалов в область несгоревшего газа. [18]
Скорость, с которой зона реакции движется по исходной смеси газов, называется скоростью горения относительно несгоревшей смеси. Поскольку зона реакции может иметь большую площадь и, по крайней мере при атмосферном давлении, незначительную толщину, ее можно условно рассматривать как поверхность или границу между продуктами горения и несгоревшими газами. Эта поверхность называется фронтом пламени. В качестве нормальной скорости горения понимается скорость горения в направлении, перпендикулярном к фронту пламени. Нормальная скорость горения, являясь функцией состава исходной смеси газов, изменяется от нескольких см / с до многих м / с и зависит от вида горючего и окислителя [2]; величина ее приближенно может быть связана с кинетикой реакции горения. [19]
Скорость получается с отрицательным знаком, который означает лишь, что если давление возрастает слева направо, то течение будет справа налево. Это не имеет существенного значения, и отрицательный знак может быть опущен. [20]
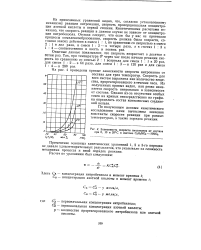 |
Зависимость скорости нитрования от состава при 0, 10 и 20 С в системе CeH5NO2 - HNO3. [21] |
Скорость для всех систем выражена как количество вещества, прореагировавшего в течение часа. Из полученных кривых видно, как резко изменяется скорость нитрования в зависимости от состава. [22]
Скорость ( в об / мин. [23]
Скорость осаждающейся в жидкости частицы под действием центробежной силы никогда не достигает предельного значения, как это имеет место при осаждении в поле тяжести. [24]
Скорости выражены в молях реагента на килограмм катализатора в час. [25]
Скорость равна константе скорости. [26]
Скорость его последующего перехода в стабильный триоксихлорид повышается с увеличением концентрации MgCl2 и водотвердого отношения суспензии. [27]
Скорость его последующего перехода в стабильный триоксихлорид повышается с увеличением концентрации MgCl j и водотвердого отношения суспензии. [28]
Скорость этих реакций заметно выше, а энергия активации ниже на дырочных образцах по сравнению с электронными. [29]
Скорости этих процессов сильно зависят от степени заполнения поверхности катализатора азотом. В дальнейшем принимаем в соответствии с механизмом Темкина - Пыжева, что покрытие поверхности катализатора водородом не оказывает сильного влияния на скорость синтеза - разложения аммиака. [30]
Страницы: 1 2 3 4