Скорость - реакция - разветвление
Cтраница 2
Иными словами, период индукции существенно зависит от соотношения скоростей реакции разветвления и обрыва цепей, но не от скорости начального инициирования активных цейтров и чувствительности измерительных приборов. [16]
При дальнейшем увеличении давления скорость реакции обрыва цепей станет больше скорости реакции разветвления, и при давлении больше Р2 самовоспламенения не происходит. [17]
При реакциях передачи цепи плотность разветвления, естественно, определяется соотношением скоростей реакций разветвления и роста, в поликонденсационных процессах - долей полифункциональных звеньев. В связи с тем, что энергия активации реакций разветвления и, соответственно, температурный коэффициент их скорости, выше энергии активации роста цепи, разветвленность большого числа полимеров увеличивается с ростом температуры; разветвленность также увеличивается с глубиной полимеризации, так как при этом возрастает вероятность взаимодействия активных центров с полимерными цепями. [18]
Особенность разветвленного цепно-теплового процесса состоит в том, что выделяющееся тепло увеличивает скорость реакций разветвления и почти не влияет на реакции обрыва, а комбинированное воздействие теплового и цепного факторов приводит к зависимости более крутой, чем экспоненциальная. [19]
Поскольку конечные продукты образуются при разветвлениях цепи, суммарная скорость цепной реакции Ф определяется скоростью реакции разветвления. Каждая элементарная реакция разветвления приводит к образованию v молекул конечного продукта; стехиометрический коэффициент v имеет порядок единицы. [20]
Поскольку конечные продукты образуются при разветвлениях цепи, суммарная скорость цепной реакции Ф определяема скоростью реакции разветвления. Каждая элементарная реакция разветвления приводит к образованию v молекул конечного продукта; стехиометрический коэффициент v имеет порядок единицы. [21]
А - постоянная интегрирования; она определяется при помощи граничного условия, которое может быть получено, если мы приравняем скорость реакции разветвления в объеме разности скоростей гибели и зарождения активных центров на поверхности сосуда. [22]
Реакции (1.106) и (1.107) не могут играть какой-либо роли, ибо хотя они и представляют собой соответственно реакции разветвления и обрыва цепи, однако скорость реакции разветвления растет с давлением быстрее, чем скорость реакции обрыва. [23]
Реакции (1.106) и (1.107) не могут играть какой-либо роли, ибо хотя они и представляют собой соответственно реакции разветвления и обрыва цепи, однако скорость реакции разветвления дастет с давлением быстрее, чем скорость реакции обрыва. [24]
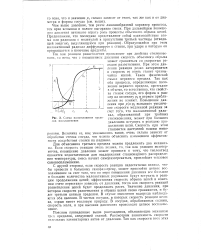 |
Схема возникновения пределов воспламенения. [25] |
С другой стороны, если скорость реакции недостаточно велика, чтобы привести к большому саморазогреву, может произойти цепное воспламенение за счет того, что по мере повышения давления все большие и большие количества малоактивных радикалов будут вступать в реакцию продолжения цепей; эффективная скорость обрыва цепей в конечном счете перестанет зависеть от давления, тогда как скорость реакций разветвления цепей будет продолжать расти. Значение давления, при котором скорости разветвления и обрыва цепей снова сравняются, и будет третьим цепным пределом. В случае окисления водорода наблюдаются оба явления. В чистых сосудах, в которых скорость реакции велика, взрыв имеет тепловую природу. В сосудах, обработанных солями, скорость мала, и при высоких давлениях происходит цепное воспламенение. [26]
Константа скорости реакции разветвления ( 2) была вычислена Н. Н. Семеновым [23] на основании опытных данных Ковальского [24], впервые изучившего кинетику горения водорода внутри области самовоспламенения при давлениях, близких давлению нижнего предела. [27]
Объяснение явления верхнего предела было уже дано, была кратко рассмотрена также его важность для выяснения механизма реакции. На пределе скорость реакции разветвления цепи равна скорости реакции обрыва, причем обе реакции имеют один и тот же порядок по активному центру. [28]
В случае реакции H2S - f - 02 максимум скорости достигается при 15 - 20 % превращения. В зависимости от соотношения между скоростями реакций разветвления и рекомбинации или реакции между двумя молекулами разветвляющего активного вещества этот максимум скорости может сместиться совсем близко к началу превращения. [29]
Если скорость размножения активных центров в результате реакций разветвления превосходит скорость их гибели при реакциях обрыва цепи, скорость образования молекул воды в рассмотренном примере будет непрерывно возрастать. Если понижение давления ведет к возрастанию скорости реакции разветвления цепи по сравнению со скоростью реакции обрыва, то ниже некоторого критического давления реакция должна, очевидно, настолько ускориться, что произойдет взрыв. [30]
Страницы: 1 2 3