Скорость - реакция - разветвление
Cтраница 3
Составим кинетическое уравнение разветвленной цепной реакции. При этом изменения п определяются скоростью начального инициирования W0, скоростями реакций разветвления и обрыва цепей. [31]
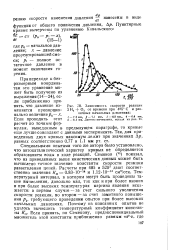 |
Зависимость скорости реакции 2 Н - J - О2 от времени при 4Я5 С и различных начальных давлениях. [32] |
Специальными опытами того же автора было установлено, что автокаталигический характер кривых не определяется образованием воды в ходе реакций. Семенов ( ц) показал, что из приведенных выше кинетических данных может быть вычислено точное значение константы скорости реакции разветвления цепей. Расчеты при 485 и 520 дают соответственно значения Kz 0.83 - 10 - 14 и 1.12 - 10 - см3 / сек. Температурный интервал, в котором могут быть проведены такие вычисления, довольно мал, так как и при более низких и при более высоких температурах картина явления искажается: в первом случае - за счет сильного увеличения скорости реакции, во втором - за счет заметного повышения pv требующего проведения опытов при более высоких начальных давлениях. [33]
С этой точки зрения является необоснованной трактовка детонационного воспламенения, как чисто цепного. Так, в работе [47] детонационные пределы для смесей Ш рассчитываются решением системы уравнений: зависимости температуры и давления в ударной волне от ее относительной скорости ( М С / с0) и соотношения между температурой и давлением в условии цепного воспламенения - равенства скорости реакции разветвления: Н Оа ОН Н, и половины скорости реакции обрыва: Н - - 02 M - HCh M. [34]
В качестве масштаба мы примем скорость гетерогенной реакции обрыва цепей в кинетической области, которая равна произведению концентрации активного центра на постоянную величину. Прямая у соответствует скорости гетерогенного обрыва в кинетической области. Прямая уз Ьр соответствует скорости реакции разветвления. Кривая y cp2 представляет собой относительную скорость реакции гомогенного обрыва. С ростом давления, однако, не все радикалы, образующиеся таким путем, приводят к обрыву цепи. С реакцией обрыва, скорость которой пропорциональна l / р, начинает конкурировать реакция продолжения цепи со скоростью, пропорциональной давлению. [35]
Однако это уравнение, как уже указывалось, не может быть применено при окислении н-декана, если полагать / срщ ( ix) и ( iv) - ( vi) постоянными в течение процесса. Очевидно, что эти изменения нуждаются в дополнительном исследовании. Кнорре, Майзус и Эмануэль [11] определили ингибиторным методом константу скорости реакции разветвления цепи при окислении н-декана. При этом оказалось, что в ходе процесса константа не претерпевает каких-либо изменений. Так как энергия активации реакции рекомбинации радикалов незначительна, а стерические факторы при переходе к различным радикалам изменяются мало, можно полагать, что константа скорости & ( ix) меняется мало, или не меняется совсем. [36]
При ф 0 производная по времени концентрации компонента, вступающего в реакцию ( активных центров), - положительна. В отличие от рассматривавшихся ранее процессов скорость реакции возрастает во времени. Эта особенность обусловлена размножением активных центров при таких режимах, когда скорость реакции разветвления больше скорости обрыва. [37]
Этот вид разветвления цепей может быть связан с другим, встречающимся в химии альдегидов. Для того чтобы могло возникнуть воспламенение, предполагаемая нами реакция разветвления цепей должна быть более высокого порядка, чем реакция обрыва цепей. Так как скорость последней, определяющаяся скоростью диффузии радикалов к стенкам сосуда, обратно пропорциональна давлению, можно было бы считать, что скорость реакции разветвления не зависит от давления. Такое представление, однако, не приводит к наблюдаемой на опыте зависимости предела воспламенения от состава смеси. Вероятность разветвления должна зависеть как от концентрации кислород. Весьма подходящие кинетические выражения могут быть получены, если предположить, что разветвление происходит при т ройном столкновении между радикалом НО2 и молекулами альдегида и кислорода. [38]
Этот вид разветвления цепей может быть связан с другим, встречающимся в химии альдегидов. Для того чтобы могло возникнуть воспламенение, предполагаемая нами реакция разветвления цепей должна быть более высокого порядка, чем реакция обрыва цепей. Так как скорость последней, определяющаяся скоростью диффузии радикалов к стенкам сосуда, обратно пропорциональна давлению, можно было бы считать, что скорость реакции разветвления не зависит от давления. Такое представление, однако, не приводит к наблюдаемой на опыте зависимости предела воспламенения от состава смеси. Вероятность разветвления должна зависеть как от концентрации кислород), так и от концентрации альдегидов. Весьма подходящие кинетические выражения могут быть получены, если предположить, что разветвление происходит при тройном столкновении между радикалом НО, и молекулами альдегида и кислорода. [39]
С этой точки зрения легко объяснить, например, возникновение полуострова воспламенения. Во втором случае из общих кинетических соображений следует, что реакция объемной рекомбинации или присоединения атома или радикала к стабильной молекуле может происходить только при тройном соударении. Наличие третьей частицы необходимо для отвода энергии реакции; в отсутствие ее образованный комплекс мгновенно распадается. Таким образом, скорость реакции объемного обрыва сильнее зависит от давления, чем скорость реакции разветвления цепей, а обрыв на стенках, наоборот, падает с ростом давления. Если скорость реакции разветвления больше, чем суммарная скорость реакции обрыва цепи, то процесс развивается лавинообразно, в реакционном сосуде образуется все нарастающее количество активных частиц, появление которых приводит к еще большему увеличению скорости - происходит взрыв. [40]
Общее аналитическое решение уравнений (8.38), (8.39) при произвольных конверсиях р не найдено. Однако структура этих уравнений является крайне простой для их численного решения на ЭВМ. Задавшись конкретным значением входящих в уравнения (8.38), (8.39) параметров, с помощью численного расчета не представляет труда определить положение гель-точки при разных величинах описывающих систему переменных. Однако для практики, по-видимому, более важной является обратная задача определения констант скоростей реакции разветвления полимерных цепей АС и & п по найденному экспериментально положению гель-точки. [41]
С этой точки зрения легко объяснить, например, возникновение полуострова воспламенения. Во втором случае из общих кинетических соображений следует, что реакция объемной рекомбинации или присоединения атома или радикала к стабильной молекуле может происходить только при тройном соударении. Наличие третьей частицы необходимо для отвода энергии реакции; в отсутствие ее образованный комплекс мгновенно распадается. Таким образом, скорость реакции объемного обрыва сильнее зависит от давления, чем скорость реакции разветвления цепей, а обрыв на стенках, наоборот, падает с ростом давления. Если скорость реакции разветвления больше, чем суммарная скорость реакции обрыва цепи, то процесс развивается лавинообразно, в реакционном сосуде образуется все нарастающее количество активных частиц, появление которых приводит к еще большему увеличению скорости - происходит взрыв. [42]
Такой вид кинетики соответствует автокатализу второго порядка с константой скорости р, сопровождаемому одновременной реакцией расходования активного продукта по первому порядку. Скорости как первой, так и второй реакции пропорциональны концентрации исходного вещества. Отношение константы скорости второй реакции к константе скорости первой реакции есть постоянная а. Пользуясь принятой в цепной теории терминологией Семенова, мы должны назвать первую реакцию процессом квадратичного разветвления, или взаимодействия цепей, а вторую - процессом обрыва цепей. Постоянная а есть отношение константы скорости реакции обрыва к константе скорости реакции разветвления цепей. [43]
Такой вид кинетики соответствует автокатализу второго порядка с константой скорости ф, сопровождаемому одновременной реакцией расходования активного продукта по первому порядку. Скорости как первой, так и второй реакции пропорциональны концентрации исходного вещества. Отношение константы скорости второй реакции к константе скорости первой реакции есть постоянная а. Пользуясь принятой в цепной теории терминологией Семенова, мы должны назвать первую реакцию процессом квадратичного разветвления, или взаимодействия цепей, а вторую - процессом обрыва цепей. Постоянная а есть отношение константы скорости реакции обрыва к константе скорости реакции разветвления цепей. [44]
Страницы: 1 2 3