Строение - гидроперекись
Cтраница 1
Строение гидроперекисей, образующихся в реакции окисления, определенно сказывается на характере их распада ( цепном или нецепном) в условиях окисления. Как уже упоминалось в предыдущем параграфе, внедрение перекисной группы в углеводородную молекулу ослабляет соседние связи С - Н и способствует цепному расходованию перекисей. Доля нецепного распада в этих случаях, как правило, невелика. Гидроперекиси, у которых нет ослабленных связей С - Н ( по сравнению с исходным веществом RH), распадаются в основном нецепным путем. К последнему случаю относятся, например, третичные гидроперекиси, над-кислоты, перекись водорода. [1]
Строение гидроперекиси подтверждается ее восстановлением йодистым калием в ледяной уксусной кислоте до карбинола. [2]
Строение олефиновых гидроперекисей было предметом больших дискуссий, в значительной степени связанных с решением вопроса о том, являются ли они циклическими перекисями или гидроперекисями. [3]
Строение гидроперекисей IV, V и VII доказано восстановлением их до соответствующих ацетиленовых спиртов, дигидроперекисей VI и VIII гидрированием до предельных гликолей анализом и ИК-спектрами. Показано, что кислород атакует Са - Н - связи в исходных углеводородах и в первую очередь третичные. Исследована кинетика распада гидроперекисей. [4]
Исследование строения гидроперекисей показало, что при окислении несопряженных олефинов, цикло-аарафинов, предельных алкилароматических и гидро-ароматических углеводородов всегда образуются гидроперекиси, в молекуле которых сохраняется такое же взаимное расположение атомов С и Н, как и в молекуле исходного углеводорода. [5]
Как видно из строения гидроперекиси, образующейся при окислении 2 7-диметилоктана, первичная атака кислорода направлена на третичную связь С - Н, место наименее прочной связи водорода с углеродом. [6]
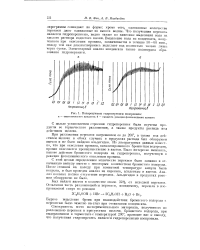 |
Полярогряммы гидроперекиси изопропила. а - синтетического продукта. б - продукта реакции фотоокисления пропана. [7] |
С целью установления строения гидроперекиси были изучены продукты ее термического разложения, а также продукты распада под действием щелочи. [8]
Данные по исследованию строения гидроперекисей и скоростей окисления различных углеводородов позволили установить некоторые закономерности, касающиеся места первичной атаки кислорода. [9]
Сравнение окисляемости изооктана ( 2 2 4-триметилпентана), 2-ме-тилгексана и 2 7-диметилоктана вместе с сопоставлением строения гидроперекисей этих углеводородов показывает что группа четвертичного углерода н алканах не окисляется н, что весьма важно, тормозит пероксидацию близко расположенной к ней третичной СН-групны, которая сама по себе в углеводородах иного строения легко реагирует с кислородом. [10]
Распад первоначально образовавшихся гидроперекисей, как и продуктов их превращений перекисного характера, важен в том отношении, что он способен генерировать вторичные окислигельные цепи, может осуществляться в различных направлениях в зависимости от условий процесса ( температуры, концентрации кислорода и др.) и строения исходной гидроперекиси. [11]
Автоокислением иара-галоидозамещенных изопропилбензола получены в чистом виде соответствующие гидроперекиси. Строение гидроперекисей доказано разложением до соответствующих тгара-галоидофенолов. [12]
Вопрос о месте атаки кислорода при окислении парафинов нормального строения был объектом длительной дискуссии с участием многих исследователей ( подробнее этот вопрос рассмотрен в гл. Тщательное изучение аутоокисления н-декана при 145 С показало, что все вторичные децилгидроперекиси образуются в одинаковых количествах. Окисление концевых ( первичных) углеродных атомов происходит в незначительной степени. Строение гидроперекисей доказано путем их каталитического восстановления до соответствующих четырех вторичных спиртов, полученных в эквимолекулярных количествах; хроматографйческое разделение показало наличие лишь следов деканола-1 и. [13]
Пако 22 показал, что при окислении дипропилкетона в присутствии никельфталоцианина основными продуктами являются масляная. Этот факт был подтвержден другими исследователями 23 на примере некатализированного окисления того же кетона при 110 С, но в этом случае наряду с кислотами получалось и небольшое количество перекиси. Выделение кислорода при обработке полученных соединений тетраацетатом свинца25 подтвердило, что они действительно являются гидроперекисями. Строение гидроперекиси, полученной из метилэтилкетона, было доказано ее каталитическим восстановлением в ацетилметилкарбинол. Гидроперекиси кетонов нормального строения обычно неустойчивы, особенно в кислой среде. Только гидроперекись, полученная из диизопропилкетона, может быть очищена путем перегонки 2б, но и в этом случае перегрев приводит, к полному разложению гидроперекиси и образованию ацетона и изомасля-ной кислоты. [14]
Вопрос о месте атаки кислорода при окислении парафинов нормального строения был объектом длительной дискуссии с участием многих исследователей ( подробнее этот вопрос рассмотрен в гл. Тщательное изучение аутоокисления н-декана при 145 С показало, что все вторичные децилгидроперекиси образуются в одинаковых количествах. Окисление концевых ( первичных) углеродных атомов происходит в незначительной степени. Строение гидроперекисей доказано путем их каталитического восстановления до соответствующих четырех вторичных спиртов, полученных в эквимолекулярных количествах; хроматографяческое разделение показало наличие лишь следов деканола-1 и. [15]
Страницы: 1 2