Упрочнение - связь
Cтраница 3
Проявление побочной валентности часто приводит к упрочнению связей, образованных за счет главной валентности. Чаще встречаются случаи стабилизации высшего валентного состояния центрального атома, хотя иногда имеет место упрочнение п его низшего валентного состояния. Двухвалентное состояние для серебра нехарактерно, по комплексное соединенно Ag ( II) с а, а - дпппрндилом ( dp) вполне устойчиво. Соли записного железа весьма легко подвержены окислению, по [ Fedp3 Cl3 окисляется с большим трудом. С другой стороны, характер насыщения главной валентности, существенно влияет на прочность связи за счет побочной валентности. [31]
Таким образом, главную роль в упрочнении связи в рядах М-X ( где М - Ni, Pd, Pt; X-Cl, Br, J) играет увеличение размеров орбиталов металлов и галогенов, так как изменение расстояний М-X сравнительно невелико. Например, в упомянутом обзоре Г. А. Кукиной приводятся расстояния М-X в комплексах платины: в K PtCU - 2 33 А, в K PtB - 2 40 А. [32]
Наблюдаемое сокращение расстояния С - С1 означает упрочнение связи С - С1, как и связи С-С ( см. стр. Причиной является малый атомный объем фтора и его сильное сродство к электронам. [33]
С течением времени в геле идут процессы упрочнения связи агрегированных частиц, сопровождающиеся выжиманием заключенной между ними дисперсионной среды и понижением степени дисперсности. Введение в гель стабилизатора ( кислоты или органической жидкости) обеспечивает на первой стадии старения сохранение индивидуальных первичных частиц при нарастании прочности образуемых ими агрегатов. Поэтому силикагели, полученные на данной стадии старения, характеризуются постоянной высокоразвитой удельной поверхностью при увеличивающемся с возрастом геля объеме пор. Второй период старения связан с постепенным понижением степени дисперсности частиц и соответственно с ослаблением стабилизирующего эффекта, что находит свое отражение в уменьшении удельной поверхности при одновременном увеличении объема пор. [34]
 |
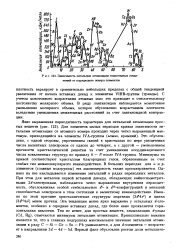
Зависимость энтальпии атомизации гомоатомных соединений от порядкового номера элементов. [35] |
Это обусловлено, с одной стороны, упрочнением связей в кристаллах по мере увеличения числа валентных электронов от одного до четырех, а с другой - уменьшением прочности кристаллической решетки за счет уменьшения координационного числа ковалентных структур по правилу 8 - N после IVA-группы. Минимумы на кривой соответствуют кристаллам благородных газов, образованным за счет слабых сил межмолекулярного взаимодействия. В больших периодах для s - и р-элементов ( главные подгруппы) эта закономерность также просматривается. Однако на нее накладывается изменение энтальпий в рядах переходных металлов. При этом для металлов первой вставной декады, обладающих кайносимметрич-ными 3 / - электронами, наблюдается четко выраженная внутренняя периодичность, обусловленная особой стабильностью ( / 5 - и f - конфигурации и меньшей способностью электронов в этом состоянии к валентному взаимодействию. Именно по этой причине кристаллические структуры марганца ( 3P4s2) и цинка ( 3i104s2) менее прочны. Эта тенденция менее ярко выражена у остальных ( / - элементов, особенно в середине вставных декад, где более явно проявляется горизонтальная аналогия. Тем не менее, для простых веществ, замыкающих rf - ряды ( Cd, Hg), отмечаются минимумы энтальпии атомизации. [36]
 |
Зависимость энтальпии атомизации гомоатомных соединений от порядкового номера элементов. [37] |
Это обусловлено, с одной стороны, упрочнением связей в кристаллах по мере увеличения числа валентных электронов от одного до четырех, а с другой - уменьшением прочности кристаллической решетки за счет уменьшения координационного числа ковалентных структур по правилу 8 - N после IVA-группы. Минимумы на кривой соответствуют кристаллам благородных газов, образованным за счет слабых сил межмолекулярного взаимодействия. В больших периодах для s - и р-элементов ( главные подгруппы) эта закономерность также просматривается. Однако на нее накладывается изменение энтальпий в рядах переходных металлов. При этом для металлов первой вставной декады, обладающих кайносимметрич ными ЗЛ-электронами, наблюдается четко выраженная внутренняя периодичность, обусловленная особой стабильностью Р - и ( / - конфигураций и меньшей способностью электронов в этом состояний к валентному взаимодействию. Именно по этой причине кристаллические структуры марганца ( 3.4 s2) и цинка ( 3P 4s2) менее прочны. Эта тенденция менее ярко выражена у остальных rf - эле-ментов, особенно в середине вставных декад, где более явно проявляется горизонтальная аналогия. Тем не менее, для простых веществ, замыкающих rf - ряды ( Cd, Rg), отмечаются минимумы энтальпии атомизации. [38]
 |
Строение молекулы 32. [39] |
Поэтому образование связи за счет гибридизации ведет к упрочнению связи. Гибридизация требует затраты энергии, которая окупается в процессе образования прочных связей. Молекулы такого типа имеют линейную форму. Например, в молекуле ВеНд образуется q2 гибридные орбитали. При этом число а-связей центрального атома, равное его координационному числу, и направленность о-связей, которая связана с типом гибридизации, определяет форму и геометрию молекул. [40]
В двумерных решетках, параллельных поверхности, могут происходить упрочнение связей в направлении, перпендикулярном поверхности, и общее сжатие системы ( такое смещение называют релаксационным), не сопровождающееся изменением конфигурации. [41]
Дезэкранировка протона и усиление межмолекулярной водородной связи приводит к упрочнению связи катион-вода. Таким образом, происходит взаимодействие межмолекулярных связей, осуществляемых одновременно по кислороду и водороду воды. [42]
 |
Электронные переходы при. [43] |
В этом случае, в отличие от предыдущего, акт упрочнения связи ( 6) сопровождается возникновением свободного электрона, а не дырки, а акт рекомбинации ( 7) - свободной дырки, а не электрона. В обоих случаях независимо от акцепторной или донорной природы хемосорбированных частиц С последовательность актов упрочнения связи и рекомбинации приводит к рождению пары свободный электрон - свободная дырка. [44]
Для ассоциированной молекулы воды интенсивность ее полос поглощения по мере упрочнения связи в комплексе быстро растет. Поэтому, даже полностью пренебрегая ван-дер-ваальсовским взаимодействием, можно получить ЭОП, весьма точно характеризующие влияние Н связи на электронное облако ОН-группы. [45]
Страницы: 1 2 3 4