Серебряный электрод
Cтраница 1
Серебряный электрод, опускают в раствор и. Отмечают время секундомером и ведут накопление AgCl в течение 10 - 20 с. Далее регистрируют вольтамперную кривую при следующих параметрах поляризации: амплитуда развертки напряжения 1 0В, и1 В / с. Измеряют высоту пика тока. [1]
Серебряный электрод готовится следующим образом: со стеклянного электрода, прилагаемого к потенциометрам, снимается верхний стеклянный футляр. Остается тонкая серебряная проволока. На эту проволоку надевается стеклянная трубочка, которая внизу запаивается так, чтобы из нее выходил кусочек серебряной проволоки длиной 3 - 5 мм. Электрод выдерживают двое суток в дистиллированной воде. [2]
Серебряный электрод погружен в 1 00 - 10 - 2 М раствор Ма25еОз, насыщенный Ag2SeC3, и в паре со стандартным водородным электродом служит катодом. Рассчитайте ПР Ag2SeO3, если потенциал ячейки равен 0 450 В. [3]
Серебряный электрод, служащий в качестве индикаторного электрода для хлорид-ионов, является примером электрода второго рода, поскольку он измеряет концентрацию ионов, не участвующих непосредственно в процессе переноса электронов. Тот же электрод, используемый в качестве индикаторного электрода для ионов серебра, функционирует как электрод первого рода, поскольку его потенциал зависит от концентрации вещества, непосредственно участвующего в электродной реакции. [4]
Серебряный электрод, погруженный в раствор 1 N КОН, насыщенный кислородом при атмосферном давлении, принимает потенциал st: 0 98 в. Как и следовало ожидать, эта величина является функцией парциального давления кислорода. На рис. 3 приведена зависимость фст от lg ро2 в интервале давлений кислорода от 1 0 до 0 1 атм. [5]
Серебряный электрод, состоящий из тонкой серебряной проволоки или посеребренного электролитическим способом платинового электрода, применим, при всех реакциях, в которых участвует ион серебра, например, при взаимодействии солей серебра с галогенидами, роданидами, цианидами, сульфидами. [6]
Серебряные электроды наносятся на пластину вжиганием с последующим процарапыванием гребенкообразной линии. Датчик измеряет относительную влажность 50 - 100 % при температурах от 15 до 45 С; в области более низкой влажности датчик имеет очень высокое сопротивление. [7]
Серебряный электрод, погруженный в разбавленный раствор с активностью Ag - HOHOB аъ растворяется и приобретает при этом отрицательный заряд. В более концентрированном растворе с активностью аг ионы серебра, наоборот, выделяются на электроде, сообщая ему положительный заряд. [8]
Серебряный электрод, погруженный в разбавленный раствор с активностью Ag - OHOB аг, растворяется и приобретает при этом отрицательный заряд. В более концентрированном растворе с активностью а2 ионы серебра, наоборот, выделяются на электроде, сообщая ему положительный заряд. [9]
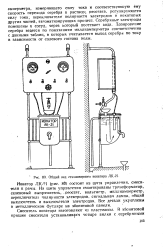 |
Общий вид стационарного ионатора ЛК-21. [10] |
Серебряные электроды помешены в сосуд, через который поотекает вода. Дозирование серебра ведется по показаниям миллиамперметра соответственно с данными таблиц, в которых учитывается выход серебра по току в зависимости от солевого состава воды. [11]
Серебряный электрод, погруженный в разбавленный ( например, 0 1 или 0 01 М) раствор соли серебра, имеет по отношению к водородному электроду потенциал меньший, чем 0 9 в. [12]
Серебряный электрод, погруженный в разбавленный раствор с активностью А § - ионов alt растворяется и приобретает при этом отрицательный заряд. В более концентрированном растворе с активностью я2 ионы серебра, наоборот, выделяются на электроде, сообщая ему положительный заряд. [13]
Серебряный электрод главным образом используется для генерации Ag при определении галогенидов и других анионов, образующих с Ад: ийалорастворимые или комплексные соединения. [14]
Серебряный электрод, погруженный в разбавленный ( например, 0 1 или 0 01 М) раствор соли серебра, имеет по отношению к водородному электроду потенциал меньший, чем 0, 8 в. [15]
Страницы: 1 2 3 4