Слабокислый электролит
Cтраница 2
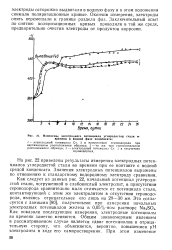 |
Изменение электродного потенциала углеродистой стали в ( времени в водной фазе конденсата. [16] |
Как следует из данных рис. 22, начальный потенциал углеродистой стали, погруженной в слабокислый электролит, в присутствии сероводорода сравнительно мало отличается от потенциала стали, контактирующей с этим же электролитом в отсутствии сероводорода, являясь отрицательнее его лишь на 20 - 30 мв. Как показали последующие измерения, электродные потенциалы во времени заметно меняются. Общим закономерным явлением в рассматриваемом случае является сдвиг потенциалов в отрицательную сторону, что объясняется, вероятно, повышением рН электролита в ходе его саморастворения. [17]
В процессе коррозии на первой стадии металл корродирует в основном в водной фазе ( в слабокислом электролите), где усиление коррозии в присутствии сероводорода обусловлено активацией анодного и катодного процесса. На второй стадии разрушение металла резко возрастает только вследствие развития коррозионного процесса в углеводородной фазе. При этом интенсификация коррозии совпадает по времени с образованием на поверхности металла объемистого осадка сульфида железа. [18]
Осаждение металлов на поверхность, покрытую проводящим или разделительным слоем, в начале производится в слабокислых электролитах меднения и никелирования. Нанесение первичного тонкого слоя металлов ( затяжка) необходимо для того, чтобы формы с нанесенными на их поверхность слоями не разрушались при воздействии агрессивных ( сильно кислых) электролитов. Затяжку необходимо выполнять в условиях, обеспечивающих получение эластичных с малыми внутренними напряжениями осадков металла, во избежание отрыва металлической пленки от формы. [19]
Кроме указанных органических соединений разработаны специальные композиции добавок - ZnSR-A и ZnSR-B, ДХТИ-102А и ДХТИ-102Б, которые вводят в слабокислые электролиты. [20]
В некоторых случаях, например, при декоративном цинковании, а также при нанесении защитного покрытия на изделия из чугуна, литья, высокоуглеродистых сталей, целесообразно применение слабокислых электролитов. Однако высокая агрессивность хлор-ионов, снижение эффективности очистки сточных вод от ионов тяжелых металлов в присутствии ионов аммония ограничивают область применения как хлоридных, так и аммиакатных электролитов. В случае, если предъявляются повышенные требования к пластичности осадков, то лучше применять безаммонийные хлоридные растворы. [21]
Поверхностное окисление титана в водных растворах протекает легче, чем его растворение. Стационарные потенциалы титана в нейтральных и слабокислых электролитах находятся в положительной области. [22]
Это также относится к пассивным системам, для которых наличие или увеличение катодных составляющих сплава ( увеличение катодной эффективности, что эквивалентно смещению стационарного потенциала коррозии в положительную сторону) вызывает анодную активацию вследствие питтингообразования. Примером тому может служить алюминий или магний в большинстве нейтральных или слабокислых электролитов, содержащих ионы хлора. [23]
Это также относится к пассивным системам, для которых наличие или увеличение их катодной эффективности ( что эквивалентно смещению стационарного потенциала коррозии в положительную сторону) вызывает анодную активацию вследствие питтинго-образования или перепаеснфа-ции. Примером первого может быть алюминий или магний в большинстве нейтральных или слабокислых электролитов, содержащих, ионы хлора, примером второго - сплавы со значительным количеством молибдена или хрома в окислительных средах. [24]
Как показывают наблюдения, коррозионный процесс в двухфазной среде, содержащей сероводород, в своем развитии проходит ряд стадий. На первой стадии металл корродирует в основном в водной фазе - в слабокислом электролите, где усиление коррозии в присутствии сероводорода обычно связывают с активацией анодного и катодного процессов. Далее коррозия стали несколько замедляется, что связано, по-видимому, с образованием на металле тонкой и беспористой пленки сульфида железа, обладающей, как известно, некоторыми защитными свойствами. Затем разрушение металла ускоряется, в данном случае исключительно за счет развития коррозионного процесса в углеводородной фазе. При этом интенсификация коррозии совпадает по времени с образованием ( преимущественно в этой части) объемистого осадка сульфида железа. [25]
Как показывают наблюдения, коррозионный процесс в двухфазной среде, содержащей сероводород, в своем развитии проходит несколько стадий. На первой стадии металл корродирует в основном в водной фазе - в слабокислом электролите, где усиление коррозии в присутствии сероводорода обычно объясняют активацией анодного и катодного процессов. Далее коррозия несколько замедляется, что связано, по-видимому, с образованием на металле тонкой и беспористой пленки сульфида железа, обладающей, как известно, небольшими защитными свойствами. В последующем разрушение металла вновь возрастает исключительно из-за развития коррозионного процесса в углеводородной фазе. При этом интенсификация коррозии совпадает по времени с образованием объемистого осадка сульфида железа, что несомненно указывает на его особую роль в процессе сероводородной коррозии. Как показали расчеты, при коррозии углеродистой стали в двухфазной среде подавляющая часть всех весовых потерь металла приходится на поверхность образца, где образовался объемистый нарост сульфида железа. После удаления продуктов коррозии обнажается сильно корродированная поверхность металла с большим количеством разрушившихся пузырей вздутия. [26]
Значительного улучшения достигают, если полученные гели нейтрализуют органическими и неорганическими основаниями или щелочными, нейтральными или даже слабокислыми электролитами ( галогенидами или окса-латами щелочных металлов или аммония), а затем смолу тщательно промывают. [27]
В двухфазной среде, содержащей подкисленный до рН 2 0 раствор NaCl, коррозионный процесс, по крайней мере в начальной его стадии, также несколько замедлен по сравнению с коррозией металла в слабокислом электролите, содержащем FeSO4, поскольку требуется некоторое время для насыщения среды ионами железа. [28]
Во влажном сероводороде в присутствии кислорода коррозионный процесс ускоряется. Коррозия под явной или невидимой ( тончайшей) пленкой электролита ( воды) имеет электрохимический механизм и связана с работой локальных микроэлементов. Сероводород облегчает протекание анодного процесса в кислых и слабокислых электролитах и одновременно тормозит электрохимическую реакцию восстановления кислорода. [29]
Создана новая подотрасль народного хозяйства - газохимическая промышленность на базе газоконденсатных месторождений с сероводородом. Освоение таких месторождений сопряжено с исключительными трудностями из-за коррозионной активности и высокой токсичности сероводорода. Растворяясь в пластовой воде, сероводород образует слабокислый электролит, взаимодействующий с металлом трубопровода. Водород - один из продуктов реакции, проникая в металл, вызывает его растрескивание. В результате происходит нарушение работоспособности трубопровода, выброс в окружающую среду токсичных компонентов. Коррозионные разрушения трубопроводов на газоконденсатных месторождениях с сероводородом специфичны. Во-первых, они могут проявляться внезапно и в массовых масштабах. Во-вторых, они могут иметь место даже при небольшом общекоррозионном эффекте и незначительном времени контактирования. В-третьих, при определенных условиях преимущественно разрушаются сварные соединения. [30]
Страницы: 1 2 3