Энергия - тройная связь
Cтраница 2
 |
Энергия химических связей углерода с различными атомами. [16] |
Из данных табл. 1.8 видно, что энергия двойной связи больше энергии одинарной, а энергия тройной связи больше, чем энергия двойной. Структуру и свойства молекул с ковалентной связью нельзя достаточно ясно представить, если полагать молекулы в статическом состоянии. Следует учитывать тепловые движения молекул и колебания отдельных групп атомов в молекулах, действие электрических и магнитных полей, а также лучистой энергии. [17]
Химические свойства ненасыщенных веществ приводят к выводу, что двойные и тройные связи слабее ординарных; но эти свойства основаны на сравнении энергии двойной связи с энергиями двух ординарных связей и аналогично энергии тройной связи с энергиями трех ординарных связей, тогда как выше речь идет о сравнении только с одной ординарное связью. [18]
Из сопоставления энергий ординарной ( 350 кДж / моль), двойной ( 610 кДж / моль) и тройной ( 840 кДж / моль) связей следует, что в соединениях ацетиленового ряда энергия тройной связи на 210 кДж / моль меньше, чем сумма энергий трех ординарных, а л-электроиы, как и в соединениях этиленового ряда, обладают высокой поляризуемостью. Поэтому для соединений ацетиленового ряда характерно большинство из рассмотренных в разд. Однако во всех этих реакциях соединения ацетиленового ряда менее реакционноспособны, чем соответствующие соединения этиленового ряда. [19]
Из сопоставления энергий ординарной ( 350 кДж / моль), двойной ( 610 кДж / моль) и тройной ( 840 кДж / моль) связей следует, что в соединениях ацетиленового ряда энергия тройной связи на 210 кДж / моль меньше, чем сумма энергий трех ординарных, а я-электроны, как и в соединениях этиленового ряда, обладают высокой поляризуемостью. Поэтому для соединений ацетиленового ряда характерно большинство из рассмотренных в разд. Однако во всех этих реакциях соединения ацетиленового ряда менее реакционноспособны, чем соответствующие соединения этиленового ряда. [20]
 |
Основные характеристики некоторых коваленгных связей. [21] |
Задание 1.10. Выпишите из табл. 1.3 значения энергии одинарной и тройной связей между атомами углерода. Почему энергия тройной связи не равна утроенному значению энергии трех одинарных связей. [22]
Энергия тройной связи в молекуле ацетилена равна 810 кДж / моль, а энергия ординарной связи в молекуле этана - 348 кДж / моль. Следовательно, энергия тройной связи не является суммарной энергией трех ординарных связей. [23]
Исследования структуры бензольного кольца привели к заключению о том, что если возможны несколько конфигураций ковалент-ных связей, то путем резонанса между различными конфигурациями может образовываться структура, соответствующая более низкой энергии. Представление о резонансе предполагает возможность существования одно - и трехэлектронных ковалентных связей с энергией, равной половине энергии соответственно единичных и тройных связей. Представление о резонансной связи было применено Полингом [5] к переходным металлам. Он предположил, что электроны ( п - 1) - подоболочки распределяются между атомными и связывающими орбиталями. Электроны, находящиеся на атомных орбиталях, связаны с отдельными атомами и обусловливают магнитные свойства металла. Электроны, расположенные на связывающих орбиталях, образуют кова-лентные связи ( путем гибридизации с ns - и пр-орбиталями), которые резонируют между большим числом направлений связи. [24]
Исследования структуры бензольного кольца привели к заключению о том, что если возможны несколько конфигураций ковалент-ных связей, то путем резонанса между различными конфигурациями может образовываться структура, соответствующая более низкой энергии. Представление о резонансе предполагает возможность существования одно - и трехэлектронных ковалентных связей с энергией, равной половине энергии соответственно единичных и тройных связей. Представление о резонансной связи было применено Полингом [5] к переходным металлам. Он предположил, что электроны ( п - 1) 2-подоболочки распределяются между атомными и связывающими орбиталями. Электроны, расположенные на связывающих орбиталях, образуют кова-лентные связи ( путем гибридизации с ns - и ир-орбиталями), которые резонируют между большим числом направлений связи. [25]
ХХ; соответствующие значения также приведены в табл. 21.9. В этом случае обнаружена закономерность, совершенно отличная от наблюдаемой для простой связи X-X. Азот образует намного более прочную тройную связь, чем остальные элементы его группы, для которых наблюдается постепенное уменьшение энергии тройной связи. Эти данные позволяют понять, почему из элементов группы 5А лишь азот устойчив при 25 С в виде двухатомных молекул. Все остальные элементы этой группы существуют при нормальных условиях в структурных формах, включающих только простые связи между атомами. [26]
Во многих реакциях алкинов происходит присоединение полярных реагентов по тройной связи. Также как двойная связь в алкенах является более слабой, чем три одинарные ст-связи ( гл. Энергия тройной связи в ацетилене составляет 200 ккал / моль, тогда как энергия углерод-углеродной связи в этане - 88 ккал / моль. Это означает, что реакции алкинов, сопровождающиеся разрывом двух тг-связей и образованием четырех новых ст-связей, термодинамически благоприятны, поскольку сопровождаются выделением тепла. [27]
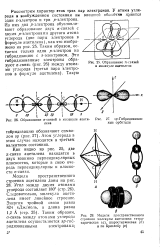 |
Образование сг-связей в молекуле ацетилена.| Модели пространственного. [28] |
Угол между двумя атомами углерода составляет 180 ( стр. Следовательно, молекула ацетилена имеет линейное строение. Энергия тройной связи равна 824 кДж / моль, а длина равна 1 2 А ( стр. [29]
На рис. 20 показаны тетраэдрическая и структурная модели этина. Угол, образованный а-связями ( углерод-углеродная и углерод-водородные), составляют 180 ( см. рис. 10), и молекула этина имеет линейное строение. Энергия тройной связи в молекуле этина равна 821 5 кдж / моль, что меньше утроенной одинарной связи ( 332 хЗ) на 174 5 кдж / моль. [30]
Страницы: 1 2 3