Энергия - тройная связь
Cтраница 3
Раньше считали, что углерод в окиси углерода двухвалентен, и приписывали ей формулу С О. Энергия связи превосходит здесь даже энергию тройной связи; то же справедливо относительно валентно-силовой константы. На основании далеко идущих совпадений в физических свойствах СО и N2 Лангмюр уже в 1919 г. предположил, что обе эти молекулы изостеричны и в соответствии с этим в молекуле СО, так же как в молекуле N2, имеется тройная связь. Отсюда следует, что молекула СО обладает сильно полярным характером ( ср. Это расхождение можно устранить предположением, что в молекуле СО имеется волново-механический резонанс между двумя формами с противоположно направленными дипольными моментами. [31]
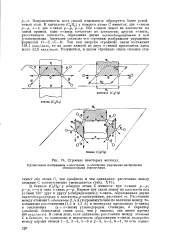 |
Строение некоторых молекул. [32] |
Направленность всех связей изменяется: образуется более устойчивый этан. В ацетилене ( С2Н2) у каждого атома С имеются: две з-связи р - Р, s - s; две я - связи р - р, р-р. Обе о-связи лежат на плоскости на одной прямой, одна я-связь стелется по плоскости; другая з-связь, рассекающая плоскость, образована двумя перпендикулярными к ней / - электронами. Так как энергия тройной связи составляет 128 1 ккал / молъ, то на долю каждой из двух тс-евязей приходится здесь всего 32 8 ккал / молъ. [33]
 |
Влияние кратности связи на ее энергию. [34] |
Между атомами углерода в молекуле ацетилена имеется одна а-связь и две я - связи, соответственно связь между атомами углерода является тройной, НССН. Тройная связь также возникает при образовании молекулы азота NN. Количество связей, образующихся между атомами, называется кратностью ( порядком) связи. С увеличением кратности ( порядка) связи изменяются длина связи / и ее энергия. На рис. 18 приведена зависимость между энергией и кратностью связи, которая имеет нелинейный характер. Энергия двойной связи не увеличивается в два раза, а энергия тройной связи не увеличивается в три раза по сравнению с энергией одинарной связи. Это вызвано тем, что энергия я-связи меньше, чем энергия а-связей; я-связь менее прочная, чем а-связь, и разрушается при химических взаимо-действиях в первую очередь. [35]
 |
Перекрывание электронных облаков при образовании п-связи. [36] |
Между атомами углерода в молекуле ацетилена имеется одна а-связь и две л-связи, соответственно связь между атомами углерода является тройной, НССН. Тройная связь также возникает при образовании молекулы азота NN. Число связей, образующихся между атомами, называется кратностью ( порядком) связи. С увеличением кратности ( порядка) связи изменяется длина связи и ее энергия. На рис. II.7 приведена зависимость между энергией и кратностью связи, которая имеет нелинейный характер. Энергия двойной связи не увеличивается в два раза, а энергия тройной связи не увеличивается в три раза по сравнению с энергией одинарной связи. Это обусловлено разницей в энергии а - и л-связей. [37]
Страницы: 1 2 3