Галогеноводород
Cтраница 2
Галогеноводороды являются растворителями с сильными кислотными свойствами. Их кислотность возрастает в ряду HF НС1 НВг HI. Следовательно, очень трудно найти какие-либо вещества, которые ведут себя как кислоты, особенно в хлористом, бромистом и йодистом водороде. Наоборот, существует очень много веществ, являющихся основаниями в галогеноводородах; некоторые из них являются сильными электролитами. [16]
Галогеноводороды для промышленных процессов галогенирова-ния большей частью используют в безводном состоянии. Все они имеют резкий запах и раздражают слизистые оболочки дыхательных путей. Фтористый водород особенно опасен - он способен разрушать кожные покровы и костную ткань. Корродирующее действие безводных галогеноводородов меньше, чем действие их водных растворов или свободных галогенов, однако в присутствии влаги необходима такая же защита аппаратуры от коррозии, как в случае свободного хлора. [17]
Галогеноводороды присоединяются к тройной связи труднее, чем к двойной. [18]
Галогеноводороды ( HF, HC1, НВг, HI) взаимодействуют с золотом в присутствии окислителей, таких, как нитраты, гипохлори-ты, хлораты, перманганаты, перекиси. [19]
Галогеноводороды представляют собой полярные молекулярные вещества. [20]
 |
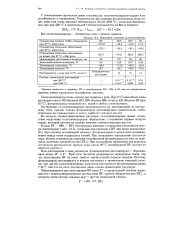
Свойства галогеноводородов. [21] |
Галогеноводороды могут образовываться в результате реакции непосредственно между соответствующими элементами. Такие реакции иногда идут со взрывом, как в случае взаимодействия Н2 с F2 или при инициировании смеси Н2 и С12 искрой или фотоном достаточной энергии. Однако реакции Вг2 или 12 с водородом протекают не столь бурно, и реакционную смесь приходится даже нагревать, чтобы она достигла равновесия. [22]
Галогеноводороды, Прочность падает в ряду от HF к HI. Растворы проявляют кислотные свойства. [23]
 |
Некоторые свойства галогеноводородов. [24] |
Галогеноводороды очень хорошо растворимы в воде. При О С один объем воды растворяет около 500 объемов НС1, 600 объемов НВг и около 425 объемов HI ( при 10 С); фтороводород смешивается с водой в любых соотношениях. [25]
Галогеноводороды оказывают сильное раздражающее воздействие на слизистые оболочки и органы дыхания, разрушают зубную эмаль. Фториды металлов - протоплазматические яды, действующие в основном на ферменты. Избыток фторид-ионов в питьевой воде вреден для зубов, а также для развития костей, как и недостаток этих ионов. При избытке фторид-ионов ( более 2 мг / л) в питьевой воде зубы чернеют и легко выпадают. [26]
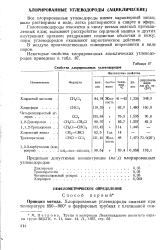 |
Свойства. хлорированных углеводородов. [27] |
Галогеноводороды относятся к числу весьма опасных промышленных ядов; вызывают расстройство сердечной мышцы и других внутренних органов; раздражают слизистые оболочки и кожу, пары углеводородов оказывают наркотическое действие. [28]
Галогеноводороды представляют собой электрофильные агенты, поэтому многие полигалогено - и полицианоалкены, например С12С СНС1, не реагируют с ними, если условия проведения реакции не способствуют реализации свободнорадикаль-ного процесса. [29]
Галогеноводород, как и сами галогены, присоединяется по двойной связи по тому же полярному механизму, причем реакцию возбуждает катион водорода. Присоединение по правилу Марковникова является еще одним доказательством справедливости предположения, что из двух ионов, которые образуются при диссоциации присоединяющейся молекулы, первым присоединяется катион. [30]
Страницы: 1 2 3 4