Металлический гидрид
Cтраница 2
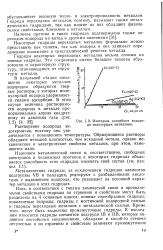 |
Изотермы адсорбции водорода некоторыми металлами. [16] |
Гидриды переходных металлов, поэтому, называют также металлическими гидридами, так как многие из них обладают физическими свойствами, близкими к металлам. [17]
Химические связи каких типов образуют атомы водорода в газообразных, полимерных и металлических гидридах. [18]
При проведении реакций гидрирования часто используют в качестве катализаторов металлические гидриды. [19]
С гидрида скандия начинается описание методов получения так называемых металлических гидридов, к которым относятся гидриды d - и / - переходных металлов. [20]
С водородом иттрий образует в интервале 314 - 1540 С устойчивые металлические гидриды различного состава. [21]
 |
Система хранения водорода в фиксированном слое гидрида. [22] |
Для нужд автомобильного транспорта создаются гидриды, которые теоретически могут содержать до 130 - 140 кг водорода на 1 м3 металлического гидрида. Но и такое содержание водорода в баке емкостью 130дм3 достаточно на 400 км пробега автомобиля. Это реальные для применения показатели, но следует учитывать увеличение массы бака, заполненного гидридом. [23]
 |
Свойства некоторых металлических гидридов.| Конденсатор, образованный двумя параллельными пластинами с площадью поверхности А и расстоянием между ними d. [24] |
Этот факт в сочетании с тем, что водородные двигатели работают фактически без загрязняющих выхлопов, делает систему аккумулирования с использованием металлических гидридов особенно привлекательной для применения в будущем. Безусловно, исследования в этой области будут продолжаться. [25]
Еще Хюттиг [18], а затем и Некрасов ( 10 ] считали, что гидриды металлов IV-Vb групп и редкоземельных металлов образуют как бы переход от металлических гидридов к соле-образным. [26]
Согласно самой общей классификации, по-видимому, первоначально намеченной в работах Смита [16], Шмидта [17] и Хюттига [18], гидриды элементов принято подразделять на три больших класса: летучие гидриды с ковалентной связью; соле-образные с электроотрицательным водородом и так называемые металлические гидриды, к которым относятся преимущественно водородные соединения переходных металлов, включая лантаноиды и актиноиды ( см. таблицу на стр. [27]
При достижении же в валентной зоне определенной электронной концентрации возникают соответствующие металлические соединения. Металлические гидриды обладают электропроводностью, металлическим блеском и другими характерными признаками металлических веществ. [28]
Фрицман [167], рассматривая каталитическую активность водородистого палладия, указывает, что в соединениях с палладием водород имеет необычную валентность ( Pd2H, Pd3H) вследствие перехода в металлическое состояние. Металлические гидриды ( МехНу) подобны металлорганическим соединениям или металалкилам, в которых алкильные группы соединены с элементом. Легкость разложения этих соединений и их способность к образованию продуктов присоединения делает их особенно подходящими для применения при синтезе и при восстановлении, а присутствие радикалов и водородных атомов придает им высокую активность. [29]
В периодах системы слева направо характер водородистых соединений изменяется так: в малых периодах гидриды металлические ионного характера сменяются полимерными гидридами и, начиная с подгруппы 4, ковалент-ными неметаллическими гидридами газообразного состояния. В больших периодах после металлических гидридов располагаются гидриды интерметаллического типа, свойственные элементам d - типа. [30]
Страницы: 1 2 3