Металлический гидрид
Cтраница 3
Отмечая низкую упругость диссоциации гидридов церия и лантана, Смит считал, например, что эти соединения не могут рассматриваться как простые растворы водорода в металлах. Они должны отличаться от чисто металлических гидридов, совмещая в себе и свойства солеобразных гидридов. [31]
Вопрос о характере связи в гидридах d - и / - элементов до сих пор остается неопределенным. В настоящее время существуют две совершенно разные теории для объяснения строения металлических гидридов. [32]
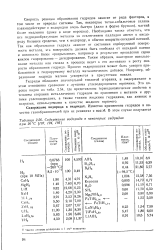 |
Содержание водорода в некоторых гидридах при 20 С ( 197, 194, 195. [33] |
Гидриды обладают значительной теплотой сгорания, и выдерживают в этом отношении сравнение с лучшими углеводородными горючими. Это хорошо видно из табл. 2.54, где представлены термодинамические свойства и теплоты сгорания металлических гидридов по сравнению с метаном и другими углеводородами, а также такими жидкими гидридами, как аммиак и гидразин, используемыми в качестве жидкого горючего. [34]
Аккумуляторные батареи, напротив, могут хранить достаточно энергии для питания лэптопов в течение нескольких часов. Обычно для этой цели использовались никель-кадмиевые элементы, но в последнее время кадмий в этих элементах был заменен металлическими гидридами, в результате чего время жизни аккумуляторов увеличилось, и, кроме того, новые элементы наносят меньший ущерб окружающей среде, когда их в конце концов приходится выбрасывать. Литиевые ионные батареи еще лучше, так как их можно перезаряжать, не дожидаясь полной разрядки, но их емкость также ограничена. [35]
Zr - Н, Ti - Н и др.; свойством, отличающим их от солеобразных и ковалентных гидридов, является переменный состав, зависящий от температуры и давления. В этом отношении гидриды переходных металлов аналогичны фазам интерметаллических соединений, что и объясняет название, часто применяемое для гидридов переходных металлов - металлические гидриды. [36]
Редкоземельные металлы и актиноиды непосредственно реагируют с водородом с выделением тепла ( на единицу валентности) примерно того же порядка, как и в случае щелочноземельных металлов ( стр. Однако абсорбция водорода у них связана со значительным расширением кристаллической решетки ( стр. Этим они отличаются от солеобразных гидридов металлов первой и второй групп и приближаются к металлическим гидридам переходных металлов более высоких групп. С последними их роднит также и склонность к образованию фаз переменного состава значительного протяжения. Состав соединений лантаноидов и актиноидов с водородом, полученных непосредственным гидрированием, показывает значительное отклонение от простых стехиометрических отношений. [37]
При теоретическом объяснении растворимости водорода в металлах используют модель диссоциации абсорбированных атомов водорода на протоны и электроны. Этой диссоциации предшествует процесс диссоциативной хемисорбции молекул водорода на поверхности металла. Можно предположить, что в гидридах никеля, палладия и платины ( в известной степени прототипах металлических гидридов вообще) освобождающиеся электроны переходят в d - зоны, у которых плотность электронных термов гораздо выше, чем в s - зонах разд. [38]
Поведение солеобразных и металлических гидридов при нагревании различно. Для солеобразного гидрида ( NaH) первый и четвертый участки имеют узкие пределы по составу; третий участок отсутствует. Это согласуется с тем, что гидрид натрия имеет постоянный состав, соответствующий стехиометрическому NaH. Для металлического гидрида ( PdHn) все четыре участка выражены явно ( рис. 1.4, б); при этом содержание водорода в гидриде может быть меньше стехиометрического; стехиометрический состав реализуется при более низких температурах. [39]
Хранение водорода в жидкой форме также имеет свои трудности. Водород сжижается при температуре - 252 87 С, и для его сжижения требуются значительные затраты энергии. Длительное криогенное хранение без больших потерь затруднительно, к тому же безопасность его хранения представляет действительно серьезную проблему. Вариантом компактного и безопасного хранения водорода является хранение его в составе особого класса компаундов - металлических гидридов. [40]
Большинство возгораний химических веществ и растворителей, которые случаются в лаборатории и имеют управляемый размер, могут быть потушены или с помощью диоксида углерода, или огнетушителем сухого химического типа. Один или более 4 5-килограммовых огнетушителей любого вида должны быть поставлены в лабораторию в зависимости от ее размера. Некоторые возгорания требуют других агентов для тушения. Возгорания с участием металлов тушатся с помощью песка или графита. Горящие металлические гидриды гасятся графитом или измельченным известняком. [41]
Нахождение электронов водорода в электронном газе соответствующей решетки металла дает основание говорить в таких случаях о металлическом типе связи водорода. Этот тип химической связи полностью реализуется лишь в гидридах переходных металлов VI-VIII групп. Основной причиной этого перехода от металлического к ионному типу связи следует считать уменьшение электроотрицательности металлов при продвижении влево по периоду и, как следствие, оттягивание валентных электронов металлов к атому водорода. В то же время гидриды переходных металлов I и II групп, также как непереходных металлов III группы занимают промежуточное положение между солеобразньши гидридами и летучими гидридами непереходных элементов V, VI и VII групп. В этом же направлении, начиная с типично металлических гидридов, наблюдается плавный переход и в типе связи - от металлической к атомной связи: валентные электроны атома водорода во все большей степени оттягиваются к его партнеру по связи вследствие возрастания электроотрицательности последнего. Таким образом, оказывается, что у гомеополярных гидридов элементов главной подгруппы VII группы атом водорода поляризован положительно. [42]
По свойствам иттрий близок к лантаноидам. При нагревании на воздухе до 370 - 425 образуется плотная черная окисная пленка, выше 760 начинается интенсивное окисление. Компактный металл медленно разлагает воду при нагревании, растворяется в обычных кислотах, медленно - в уксусной. Устойчив по отношению к щелочам. При нагревании взаимодействует с галогенами, серой, фосфором, азотом, углеродом. С водородом образует в интервале 315 - 1540 устойчивые металлические гидриды различного состава. [43]
Для получения систем полос посредством введения в пламя добавочных веществ необходимо, чтобы они внутри пламени переходили в газообразное состояние. Это ограничивает возможность исследования некоторых веществ, не имеющих достаточно летучих соединений. Однако эти ограничения не так существенны, как это кажется на первый взгляд. Целый ряд соединений, спектры которых надо получить, нет надобности вводить в пламя; они могут быть получены в результате химической реакции внутри пламени. Так, в указанном выше примере, хотя углерод принадлежит к числу наименее летучих веществ, полосы С2 все же легко наблюдать во время сжигания углеводородов, даже когда наблюдение ведется в пламени свечи. Спектры многих металлических окислов можно получить, вводя в пламя сам металл или ( более общий метод) летучее галоидное соединение металла. Химические реакции в пламени позволяют также получить в пламени спектры многих металлических гидридов в тех случаях, когда металл не образует с водородом стойкого соединения. Например, спектры MgH и СиН можно получать, вводя порошок металла в водородное пламя, а спектр NiH - давая парам карбонила никеля смешиваться с водородом. В приведенных до сих пор примерах получаемые в пламени системы полос легко получить и другим путем, главным образом в электрической дуге или разрядной трубке. Однако известно небольшое число систем, которые легко возбуждаются в пламени, но еще не были получены или только с трудом получались в других источниках. [44]
Страницы: 1 2 3