Давление - насыщенный пар - вещество
Cтраница 3
Большое влияние на образование горючих смесей оказывает способность вещества к испарению. Скорость испарения определяется давлением насыщенного пара вещества и температурой окружающей среды. Для оценки опасности насыщенных паров горючих жидкостей используют температурные пределы воспламенения. [31]
Давление насыщенного пара каждого стабильного химического вещества определяется только температурой. При неизменной температуре Т давление насыщенного пара вещества р - величина постоянная, характерная для данного вещества, и измеряется в мм рт. ст., Па, Я / ма. [32]
Рассмотрим сначала теплообмен при кипении жидкостей. Процесс кипения происходит, когда давление насыщенного пара вещества равно внешнему давлению. При этом необходимым условием передачи теплоты от твердой поверхности к кипящей жидкости является перегрев поверхности относительно температуры насыщения. [33]
 |
Прибор для определения давления насыщенного пара по Дрюсу. [34] |
Через исследуемое вещество пропускают ток инертного газа. При соответствующей малой скорости газового потока давление насыщенного пара вещества становится равным его парциальному давлению в смеси. Увлеченный газообразным потоком пар исследуемого вещества выделяют из смеси конденсацией или вымораживанием и определяют взвешиванием, либо его связывают каким-либо реагентом и после этого определяют соответствующим количественным методом. [35]
Р-V-Т данным отличается тем преимуществом, что позволяет провести определение на той же установке одновременно с получением зависимости Р-V-Т. Этот метод заключается в проверке постоянства давления насыщенного пара вещества при постоянной температуре для обеих ветвей ( жидкой и газовой) пограничной кривой. [36]
 |
Типы мешалок, применяемых в работах. [37] |
Аппаратура в усовершенствованном методе остается в принципе такой же, что и описанная в работе [31, 40], кроме некоторых деталей; к ним относится сильфонная коробка с мешалкой, соединенной с сосудом для кристаллизации, что необходимо для изоляции образца от атмосферы во время опытов. Весь эксперимент ведется в вакууме под давлением насыщенного пара вещества. [38]
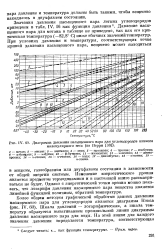 |
Диаграмма давления насыщенного пара для углеводородов низкого молекулярного веса ( по Перри. [39] |
Изменение энергетического уровня является предметом термодинамики и в настоящей книге рассматриваться не будет. Однако с энергетической точки зрения можно показать, что логарифм давления насыщенного пара вещества является линейной функцией величины, обратной температуре. [40]
Учитывая, что нас могут интересовать только те корни уравнения / 24 /, которые расположены на интервале / 0 1 /, можно провести некоторый предварительный анализ. В качестве начальных значений для К, задаются идеальные, т.е. отношение давления насыщенного пара вещества к давлению системы. [41]
В закрытом цилиндрическом сосуде с площадью основания S находится вещество в газообразном состоянии вне поля тяготения Земли. Масса газа равна М, давление р, причем Р Рнао гДе Рнас - давление насыщенных паров вещества при данной температуре. Сосуд начинают разгонять с ускорением а, направленным по оси цилиндра. [42]
Для газов приводится еще логарифм константы диссоциации lgK ( T) на элементы и для конденсированного состояния lgP ( T), где Р - давление насыщенного пара вещества. Таблицы термодинамических свойств рассчитаны для широкого интервала температур: от 100 К до температуры, при которой давление насыщенного пара вещества или продуктов его диссоциации достигает 100 атм, для конденсированного состояния и для газов от 100 до 2000, 6000 или 10000 К. [43]
Уравнение ( 12) в графике, представляющем зависимость lgPa от IgPf, в декартовых координатах, имеет вид, очевидно, прямой линии. Это дает возможность - весьма удобно провюдить нужные расчеты графическим путем, допуская не только интерполяцию, но и экстраполяцию в довольно широких пределах давления насыщенного пара веществ по двум известным точкам и кривой давления насыщенного пара эталонного вещества. [44]
Поэтому с помощью уравнения (7.11), аналогично случаю для гомогенных реакций, можно доказать закон действующих масс. Отличие будет состоять лишь в том, что в выражение константы равновесия войдут не только парциальные давления газообразных веществ, но и давление насыщенного пара веществ, находящихся в конденсированном состоянии. [45]
Страницы: 1 2 3 4