Диффузия - атомарный водород
Cтраница 1
Диффузия атомарного водорода или даже ионизированного водорода ( Н, Н) следует совершенно иным температурным зависимостям и диффузия в металлах очень заметна уже при 170; см. о явлениях, наблюдавшихся Даркеном и Смитом ( L. S. Darken, R. P. Smith [706], 5, 1948, 1 - 16); о чешуйчатом отслаивании эмалей см. С. [1]
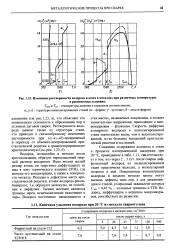 |
Изменение растворимости водорода и азота в металлах при различных температурах. [2] |
Скорость диффузии атомарного водорода в низколегированной стали значительно выше, чем в высоколегированной, из-за больших искажений кристаллической решетки в последней. [3]
Здесь D - коэффициент диффузии атомарного водорода - диффузионным переносом других реагентов пренебрегаем. [4]
При Гг2 700 К скорость распространения пламени определяется в основном скоростью диффузии атомарного водорода. В области 2 300Гг2 700 К скорость распространения пламени зависит почти в одинаковой мере как от передачи тепла, так и от скорости диффузии активных частиц: радикалов ОН, атомарного кислорода и водорода. [5]
Явление передачи перенапряжения на неполяризуемую сторону мембраны вызвано, очевидно, диффузией атомарного водорода через мембрану. [6]
При эксплуатации заводского оборудования отмечены случаи, опасного коррозионного разрушения стенок стальных аппаратов, в результате диффузии атомарного водорода ( наводороживание) через дефекты в стали с последующей рекомбинацией атомов, образующих молекулярный водород, уже не способный диффундировать обратно из металла. В таких местах могут возникнуть опасные напряжения, приводящие к разрушению или расслоению металла. [7]
Согласно [26], снижение механических свойств алюминиевых сплавов под влиянием пористости представляет один из видов косвенного проявления водородной хрупкости. Водород может удаляться в виде пузырьков, а также вследствие диффузии атомарного водорода. При этом в растворенном состоянии остается всего 0 0004 вес. [8]
Многочисленные поздние исследования подтвердили это качественно, но общепризнанного объяснения этому факту до сих под не найдено. Причинами уменьшения прочности могут служить хрупкость основного материала в результате диффузии атомарного водорода, собственные напряжения растяжения в твердом покрытии и действие насечки, возникающей в результате наличия трещин или образования их под нагрузкой. [9]
Обратной диффузии атомарного водорода может воспрепятствовать нарастающий или полностью осажденный слой гальванического покрытия. Так как в макроскопических полостях материала водород объединяется в молекулы и при этом вследствие непрерывно продолжающейся диффузии атомарного водорода образует высокие давления, вредное его влияние очевидно. Барденхойер и Плоум предполагают, что давления могут достигать нескольких тысяч атмосфер. Так как технические материалы почти всегда неоднородны и в их структуре есть полости, находящиеся под внутренним давлением, то эти полости действуют аналогично мелкой насечке и снижают прочность материала. Понятие внутреннее действие насечки может поэтому быть распространено также на действие образовавшегося внутри материала молекулярного водорода. [10]
Далее ( в Приложениях I-IV) будут более подробно описаны методы практического применения ингибиторов в кис лых средах. При выборе ингибитора важно знать, насколько эффективно он замедляет растворение металла и как влияет на диффузию водорода в металл, обусловливающую водородную хрупкость металла ( стр. Многие ингибиторы травления затрудняют диффузию атомарного водорода в металл. Интересно отметить, что скорость других химических процессов, протекающих с участием кислоты, например растворение окислов металла, карбонатов и других солей, почти не изменяется в присутствии замедлителей коррозии. Другими словами, действие ингибиторов обычно имеет избирательный характер и относится только к определенному типу реакций, а именно, к реакциям между металлом и кислотой. Очень часто ингибитор, достаточно эффективно тормозящий растворение в одной кислоте, сравнительно слабо влияет на растворение этого же металла в другой кислоте, при одинаковой активности обеих кислот. Так, амины, особенно высокомолекулярные, замедляют коррозию сталей в соляной кислоте гораздо интенсивнее, чем в серной. [11]
Далее ( в Приложениях I-IV) будут более подробно опи -, саны методы практического применения ингибиторов в кис - лых средах. При выборе ингибитора важно знать, насколько, эффективно он замедляет растворение металла и как влияет на диффузию водорода в металл, обусловливающую водородную хрупкость металла ( стр. Многие ингибиторы трав-ления затрудняют диффузию атомарного водорода в металл. Интересно отметить, что скорость других химических процессов, протекающих с участием кислоты, например растворение окислов металла, карбонатов и других солей, ; почти не изменяется в присутствии замедлителей коррозии. Другими словами, действие ингибиторов обычно имеет избирательный характер и относится только к определенному типу реакций, а именно, к реакциям между металлом и кислотой. Очень часто ингибитор, достаточно эффективно тормозящий растворение в одной кислоте, сравнительно слабо влияет на растворение этого же металла в другой кислоте, при одинаковой активности обеих кислот. Так, амины, особенно высокомолекулярные, замедляют коррозию сталей в соляной кислоте гораздо интенсивнее, чем в серной. [12]
Напряжения сжатия в покрытии возникают при толщине 50 мкм. При переменных нагрузках такие покрытия уменьшают ( иногда до 70 %) прочность стальных ( особенно углеродистых) деталей. Причинами этого могут служить хрупкость основного металла в результате диффузии атомарного водорода; собственные напряжения покрытий и др. В отличие от других гальванических покрытий для хромовых существует зависимость между снижением предела выносливости и толщиной покрытия. С увеличением гк от 25 до 100 А / дм2 он резко снижается. [13]
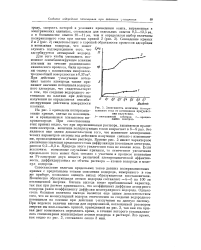 |
Зависимость величины поляризующего тока от потенциала при дейст-вии излучения. [14] |
Количество образующихся атомов водорода составляет - 4 - 5 на 100 эв поглощенной энергии. Оценка выхода носит приближенный характер, так как при расчете принималось, что коэффициент диффузии атомарного водорода равен коэффициенту диффузии молекулярного водорода. Однако столь большая величина выхода является еще одним доказательством того, что не молекулярный водород ответственен за создание водородного потенциала на платине при действии - [ излучения на данную систему. При подсчете величин выхода для определенной, поглощенной раствором энергии мы пользовались кривой, приведенной на рис. 3, так как эта кривая дает возможность определить время, в течение которого устанавливалась стационарная концентрация атомов водорода в растворе. Это время, как видно из рис. 3, составляло около 3 мин. [15]
Страницы: 1 2