Полученная константа - скорость
Cтраница 1
Полученные константы скорости, энтальпии и энтропии активации представлены в таблице. [1]
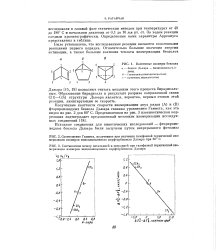
Полученные константы скорости изомеризации двух рядов ( А) и ( В) фторпроизводных бензола Дьюара связаны уравнением Гаммета, как это видно из рис. 2 для 80 С. [3]
Вновь полученные константы скорости были определены с точностью, превосходящей точность первоначальных опытов примерно в 10 раз, и при этом оказались на 7 - 18 % больше, чем было найдено ранее. Было показано, что Еа имеет пологий максимум при сравнительно высоких температурах. В табл. 12 1 приведены результаты одного типичного кинетического опыта, который продолжался около месяца. Если построить график зависимости концентрации от времени в большем масштабе, то время четвертьпревращения оказывается равным 19 850 мин, а время полупревращения - 46 960 мин. [4]
Вновь полученные константы скорости были определены с точностью, превосходящей точность первоначальных опытов примерно в 10 раз, и при этом оказались на 7 - 18 % больше, чем было найдено ранее. Было показано, что Еа имеет пологий максимум при сравнительно высоких температурах. Если построить график зависимости концентрации от времени в большем масштабе, то время четвертьпревращения оказывается равным 19 850 мин, а время полупревращения - 46 960 мин. [5]
Полученная константа скорости первой реакции является некоторой средней константой образования моноизомеров а - и ( 3-хлорэтилбензолов. Для того чтобы определить константу скорости образования каждого из этих моноизомеров в отдельности, необходимо иметь хотя бы еще одну зависимость скоростей их образования. Эту недостающую информацию можно получить, если проанализировать данные, которые дает нам математическое описание протекания реакции по элементарным стадиям каждой ступени. [6]
Тогда экспериментально полученная константа скорости равна произведению константы равновесия на константу скорости Kk. При изучении [6, 68] взаимодействия сильных кислот с некоторыми металлоорганиче-скими соединениями было обнаружено, что часто образуется связь металл - протон. Предполагают, что связь М - С в катионной прото-нированной форме более слабая, в результате чего система должна быть более лабильной. [7]
Весьма знаменательно, что полученные константы скорости не содержат адсорбционных величин. Поэтому энергии активации являются истинными энергиями активации. [8]
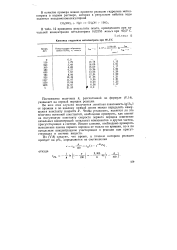 |
Кинетика гидролиза метилнитрата при 90 5 С. [9] |
Чтобы установить, является ли эта величина истинной константой, необходимо проверить, как влияет на полученную константу скорости первого порядка изменение начальных концентраций остальных компонентов и других частиц, присутствующих в системе. Иными словами, необходимо проверять выполнение закона первого порядка не только по времени, но и по начальным концентрациям участвующих в реакции или присутствующих в системе веществ. [10]
Чтобы установить, является ли эта величина истинной константой, необходимо проверить, как влия р на полученную константу скорости первого порядка изменение начальных концентраций остальных компонентов и других частиц, присутствующих в системе. Иными словами, необходимо проверять выполнение закона реакции первого порядка не только по времени, но и по начальным концентрациям участвующих в реакции или присутствующих в системе веществ. [11]
Для этого исследуют взаимодействие различных радикалов с одним н тем же субстратом ( например, толуолом) ц относят полученные константы скоростей реакций к одному из радикалов. [12]
Поэтому, проверяя, имеет ли реакция первый порядок, необходимо установить не только выполняется ли свойственная в этом случае зависимость [ А ] от t, но также проверить, как влияет на полученную константу скорости первого порядка изменение начальных концентраций других компонентов. Иными словами, необходимо проверять выполнение первого порядка не только по времени, но и по начальным концентрациям участвующих в реакции или присутствующих в системе веществ. [13]
Таким образом, присутствие свободных радикалов часто указывает на многостадийный характер механизма реакции. Полные порядки могут быть простыми, но полученные константы скорости являются комбинациями констант скоростей, относящихся к отдельным стадиям реакции. Иногда все же возможно получить информацию относительно константы скорости отдельной мономолекулярной реакции, как, например, при мономолекулярном распаде хлористого метила. [14]
В табл. XI.5 приведены данные по скоростям мономолекулярного разложения стабильных молекул на свободные радикалы; эти данные, по-видимому, количественно наименее надежны из всех данных по мономолекулярным реакциям. Причина этого состоит в том, что полученные константы скорости были выведены из суммарной наблюдаемой скорости для сложных реакций. Это - неизбежная трудность с реакциями, включающими образование свободных радикалов, которые, будучи активными промежуточными частицами, должны исчезать в результате вторичных реакций. [15]
Страницы: 1 2