Ассоциация - молекула - растворитель
Cтраница 2
При растворении часто происходит не только разрыв связей в растворяемом веществе, но и разрушение ассоциаций молекул растворителя. В образующемся растворе возникают новые ассоциации как из молекул растворителя, так и растворенного вещества ( особенно при больших его концентрациях), а также ассоциации из обоих видов молекул. [16]
К; цц - вязкость жидкости в слое г, спз; / 3 - параметр, учитывающий ассоциацию молекул растворителя. [17]
В схеме не рассмотрены последние два вида взаимодействия, так как в разбавленных растворах, о которых идет речь, ассоциация молекул растворителя не нарушается, а ассоциаты молекул растворенного вещества под влиянием растворителя полностью диссоциируют на мономерные молекулы. Тем не менее ассоциацию молекул растворенного вещества приходится учитывать при рассмотрении свойств электролитов в апротонных растворителях ( бензол, четыреххлористый углерод), в которых электролиты ( кислоты, основания и соли) ассоциированы и в разбавленных растворах ( см. гл. [18]
В схеме не рассмотрены Последних два вида взаимодействия, так как в разбавленных растворах, о которых идет речь, ассоциация молекул растворителя не нарушается, а ассоциаты молекул растворенного вещества под влиянием растворителя полностью диссоциируют на мономерные молекулы. [19]
В схеме не рассмотрены последние два вида взаимодействия, так как в разбавленных растворах, о которых идет речь, ассоциация молекул растворителя не нарушается, а ассоциаты молекул растворенного вещества под влиянием растворителя полностью диссоциируют на мономерные молекулы. Тем не менее ассоциацию молекул растворенного вещества приходится учитывать при рассмотрении свойств электролитов в апро-тонных растворителях ( бензол, четыреххлористый углерод), в которых электролиты ( кислоты, основания и соли) ассоциированы и в разбавленных растворах ( см. гл. [20]
В настоящее время слабо освещен в литературе вопросю влиянии ассоциации молекул растворителей на дисперсионный и индукционный эффекты и влияние структуры углеводородных радикалов на процесс ассоциации молекул растворителей. [21]
К недостаткам криоскопического метода следует отнести длительность проведения эксперимента, связанную с необходимостью повторного нагрева и охлаждения, а также возможность ошибок за счет переохлаждения раствора и ассоциации молекул растворителя при низких температурах, возможное выпадение полимера из раствора при понижении температуры. [22]
Как показано в одной из работ автора [54], увеличение осмотического коэффициента фр при возрастании моляльной концентрации мономерных звеньев, которое наблюдается в ионитах с большим числом поперечных связей, указывает на взаимодействие между противоионами и растворителем; при этом степень ассоциации молекул растворителя с противоионами после максимального растяжения цепей полимера остается постоянной, несмотря на дальнейший рост моляльной концентрации. [23]
Как показано в одной из работ автора [54], увеличение осмотического коэффициента срр при возрастании моляльной концентрации мономерных звеньев, которое наблюдается в ионитах с большим числом поперечных связей, указывает на взаимодействие между противоионами и растворителем; при этом степень ассоциации молекул растворителя с противоионами после максимального растяжения цепей полимера остается постоянной, несмотря на дальнейший рост моляльной концентрации. [24]
Кроме сил Ван-дер - Ваальса в образовании растворов ( углеводородов) большую роль играют водородные связи, которые образуются при взаимодействии электроотрицательного атома кислорода, фтора, азота и в слабой степени атома хлора с атомом водорода. Наличие водородной связи приводит к ассоциации молекул растворителя и уменьшению его растворяющей способности. Водородные связи образуются в большей степени при понижении температуры. При образовании водородных связей взаимодействие диполей в ряде случаев имеет второстепенное значение. [25]
В первом случае большое значение имеют дипольные моменты и диэлектрические постоянные растворителей, объем растворенных молекул, разница между их дипольными моментами в основном и возбужденном состояниях. Во втором случае имеет место донорно-ак-цепторное взаимодействие, ассоциация молекул растворителя и люминофора, образование между ними водородных связей. [26]
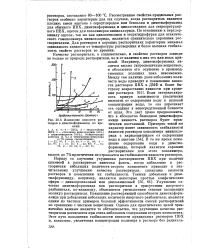 |
Изменение вязкости растворов в диметилформамиде во времени. [27] |
Наряду со случаями ухудшения растворимости ПВХ при наличии примесей в растворителе известны факты, когда добавление к растворителю небольших количеств второго компонента приводит к значительному улучшению качества растворителя: снижению вязкости растворов и повышению их стабильности. Улучшение качества диметилформамида как растворителя в присутствии инертного разбавителя, по-видимому, объясняется уменьшением степени ассоциации молекул растворителя. Повышение растворяющей способности диметилформамида при добавлении небольших количеств инертного разбавителя, является одним из частных примеров большей эффективности смесей растворителей по сравнению с чистыми веществами. Однако для практических целей чрезвычайно важным является то обстоятельство, что улучшение качества растворителя достигается при очень небольшом содержании второго компонента. [28]
Мы можем теперь сказать с известной уверенностью, что свободная энергия растворения зависит от двух факторов: 1) эффекта концентрации и 2) эффекта ассоциации. Последний эффект в свою очередь можно далее подразделить на 2а) ассоциацию молекул растворенного вещества друг с другом, 26) ассоциацию молекул растворителя друг с другом и 2в) ассоциацию молекул растворенного вещества с молекулами растворителя. Немало было сделано попыток индивидуализировать каждый из этих четырех эффектов. Для наших же надобностей будет вполне достаточно признать, что, работая в разбавленных растворах, можно уменьшить влияние фактора 2а почти до нуля, а фактор 26 можно считать практически постоянной величиной при работе только с одним растворителем. [29]
Константы / ск, / с, скорости нарастания вязкости, полученные из уравнений ( 1) и ( 2), отражают совокупность различных стадий процесса структурирования растворов комплексов, протекающих параллельно и последовательно. Формирование надмолекулярной структуры растворов комплексов при взаимодействии алкок-сидов бора и лития включает такие основные стадии, как образование мономерного комплекса, ассоциация его по литий-кислородной связи и алкильным фрагментам, ассоциация молекул растворителя иод влиянием комплекса. О связи происходят, очевидно, спонтанно и очень быстро. Суммарная скорость этих стадий зависит от концентрации исходных алкоксидов бора и лития. Лимитирующими стадиями скорости структурирования являются межмолекулярная ассоциация комплексов по алкильным заместителям, ориентация и упаковка молекул растворителя, которые приводят к повышению вязкости растворов. О связи, намного выше k скорости роста вязкости, которую в основном определяют более медленные стадии. Однако скорости медленных и быстрых стадий процесса структурообразования в растворах взаимозависимы. [30]
Страницы: 1 2 3