Электрохимическая коррозия - металл
Cтраница 4
Определение электрохимической коррозии металлов также не указывает на отличительные особенности этого процесса. Электрохимическая коррозия металла - это процесс взаимодействия металла с коррозионной средой ( раствором электролита), при котором ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте, а их скорости зависят от электродного потенциала. [46]
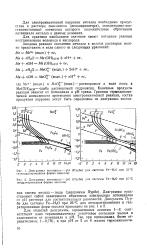 |
Диаграмма потенциал - рН ( Пурбе для системы Fe - Н2О при 25 С ( негидратированная форма окислов.| Диаграмма потенциал - рН ( Пурбе для системы Fe - Н2О при 25 С ( гидратированная форма окислов. [47] |
Для электрохимической коррозии металла необходимо присутствие в растворе окислителя ( деполяризатора), окислительно-восстановительный потенциал которого положительное обратимого потенциала металла в данных условиях. [48]
При электрохимической коррозии металлов наряду с первичными протекают вторичные коррозионные реакции: первичные продукты коррозии взаимодействуют друг с другом или с электролитом и растворенными в нем газами с образованием вторичных ( обычно труднорастворимых) продуктов коррозии. [49]
Определение электрохимической коррозии металлов также не указывает на отличительные особенности этого процесса. Электрохимическая коррозия металла - это процесс взаимодействия металла с коррозионной средой ( раствором электролита), при котором ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте, а их скорости зависят от электродного потенциала. [50]
Различают химическую, биохимическую и электрохимическую коррозию металлов. Химическая коррозия металлов представляет собой их самопроизвольное разрушение, в основе которого лежат законы обычных гетерогенных химических реакций. Разрушение металлов под действием агрессивных газов при высоких температурах, исключающих конденсацию влаги на поверхности металла, а также, по-видимому, их растворение в условиях контакта с органическими средами, не проводящими тока, относятся к процессам химической коррозии. Биохимическая коррозия, или биокоррозия, вызывается жизнедеятельностью различных микроорганизмов или использующих металл как питательную среду, или выделяющих продукты, действующие разрушающе на металл. Биокоррозия обычно накладывается на другие виды коррозии. Для ее развития наиболее благоприятны почвы определенных составов, застойные воды и некоторые органические продукты. [51]
Различают химическую, биохимическую и электрохимическую коррозию металлов. [52]
Большей частью электрохимическая коррозия металлов вызывается не одной из этих причин, а их совокупностью. [53]
 |
Реальные ( 1 и 2 и идеальные ( 3 и 4 поляризационные кривые. [54] |
Рассмотренный механизм электрохимической коррозии металлов и сплавов в основном принят применительно к двухэлек-тродной системе. Рассмотрение механизма коррозии таких систем в виде двухэлектродных элементов оказывается недостаточным, так как в этих условиях возникают многоэлектродные макро - и микрогальванические элементы. Как будут вести себя замкнутые в общую цепь электроды с различными начальными потенциалами и поляризационными характеристиками, будет зависеть от многих причин. [55]
Рассмотренный процесс электрохимической коррозии металла относится к случаю, когда в электролите находятся две металлических пластинки, имеющие разные потенциалы и соединенные между собой электрически. [56]
Важной особенностью электрохимической коррозии металла является наличие двух одновременно протекающих сопряженных процессов: анодного окисления металла и катодного восстановления окислителя. Примером такого процесса является сернокислотная коррозия воздухоподогревателей. [57]
 |
Схема пятиэлектрод - Электролит При ЭЛеКТрОХИМИЧССКОЙ. [58] |
Современная теория электрохимической коррозии металлов не противопоставляет два пути ( гомогенный и гетерогенный) протекания процесса, полагая, что соответствующие теоретические положения, основанные в обоих случаях на использовании электрохимической термодинамики и кинетики, дополняют друг друга, так как каждое из них имеет свои границы применения. В связи с этим попытки необъективной критики одной из этих теорий1 являются ненужными. [59]
Дальнейшее протекание электрохимической коррозии металла протекает при наличии веществ, уменьшающих поляризацию электродов и называемых деполяризаторами. [60]
Страницы: 1 2 3 4