Атом - галоген
Cтраница 2
Атомы галогена в ароматических системах могут равным образом мигрировать. [16]
Атомы галогенов в о - и п-положениях к гидроксильной группе усиливают кислотные свойства галогенфенолов, благодаря чему они образуют более устойчивые соли. Трибромфенол дает серебряную соль. [17]
Атомы галогенов в о - и n - положениях к гидроксильной группе усиливают кислотные свойства галогенфенолов, благодаря чему они образуют более устойчивые соли. Трибромфенол дает серебряную соль. [18]
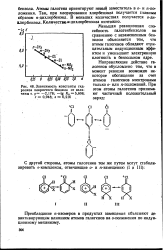 |
Зависимость константы гидролиза хлористого бензила от величины о. р - 2 178. - lg К0 5 608. г 0 948., 0 216 ч. [19] |
Атомы галогена ориентируют новый заместитель в о - и л-по-ложения. Так, при хлорировании хлорбензола получается главным образом n - дихлорбензол. В меньших количествах получается о-ди-жлорбензол. [20]
Атомы галогенов в о - и n - положениях к гидроксильной группе усиливают кислотные свойства галогенфенолов, благодаря чему они образуют более устойчивые соли. Трибромфенол дает серебряную соль. [21]
Атом галогена в галогенопроизводных не находится в диссоциированном состоянии, не образует ионов, и поэтому эти вещества при обычных условиях, как правило, не дают осадка галогенидов серебра. Тем не менее атомы галогенов обладают некоторой подвижностью, причем неодинаковой для различных галогенов: фтор в галогенопроизводных связан наиболее прочно, а иод отличается наибольшей подвижностью. [22]
Атом галогена, являющийся электроотрицательным, притягивает к себе электрон от соседнего углеродного атома ( в схеме показано стрелкой), вследствие чего последний приобретает некоторый положительный заряд. [23]
Атом галогена в пиранозном цикле занимает по отношению к атому кислорода аксиальное, а не экваториальное положение, приводя к так называемому аномерному эффекту. Этот эффект определяется стабилизующим взаимодействием я-не-поделенной пары кислорода с низколежащей пустой орбиталью сгсх. [24]
Атомы галогена, обладающие высокой подвижностью, заме щаются. [25]
Атомы галогенов не только представляют собой хорошую уходящую группу при нуклеофилыюм замещении, но и оттягивают электроны от соседнего атома углерода. Алкилгалогениды участвуют во многих реакциях нуклеофильного замещения. Уже упоминались реакции со спиртами и аминами, большую ценность представляют также реакции с тиолат-ионами, цианид-ионами, с анионами - производными ацетилена и другими кар-банионами ( см. разд. Однако сопутствующие реакции элиминирования могут осложнять ситуацию, особенно в случае вторичных алкилгалогенидов, а из некоторых третичных алкилгалогенидов вообще получают лишь продукты элиминирования. [26]
 |
Структура метилмеркурхлорида H3C - Hg-Cl.| Мотив структуры стибинов.| Возможные изомеры для стибинов. [27] |
Атомы галогена расположены на полюсах, а метальные группы - в экваториальной плоскости. [28]
Атом галогена, стоящий у двойной связи, явно приближается по химическим свойствам к ароматически связанному галогену. Поэтому отщепление галогеноводорода во второй стадии происходит только при действии сильных агентов или высокой температуры. [29]
Атом галогена у углерода с двойной связью ( в том числе и в арйлгалогенидах) связан очень прочно и с трудом вступает в обычные реакции галогенидов. Так, гидролиз и другие реакции нуклеофильного за-мещения хлористого винила и хлорбензола и тому подобных соединений крайне затруднен. Арилгало-гениды нормально реагируют с Mg в эфире, винил-галогениды в эфире не вступают во взаимодействие с Mg; как было недавно показано, гриньяровы синтезы могут быть легко осуществлены с винилгалогени-дами в среде тетрагидрофурана. [30]
Страницы: 1 2 3 4