Атом - первая группа
Cтраница 1
Атомы первой группы ( с шестерной координацией) располагаются по вершинам слегка искаженного икосаэдра ( фиг. Трех внешних электронов у каждого атома бора явно недостаточно, чтобы обеспечить во всей структуре систему связей из парных электронов. [1]
Для атомов первой группы периодической системы, валентный электрон которых находится в состоянии с / (), момент импульса всего атома равен спину валентного электрона. [2]
Для атомов первой группы периодической системы, валентный электрон которых находится в состоянии с / О, момент импульса всего атома равен спину валентного электрона. [3]
Для атомов первой группы периодической системы, валентный электрон которых находится в состоянии с 10, момент импульса всего атома равен спину валентного электрона. [4]
Для атомов первой группы периодической системы, валентный электрон которых находится в состоянии с / 0, момент импульса всего атома равен спину валентного электрона. [5]
Нормальные состояния атомов первой группы периодической системы принадлежат к состоянию S ( L 0), вследствие чего полный механический момент атома совпадает со спиновым моментом валентного электрона. [6]
Показать, что для атомов первой группы, у которых уровни энергии Е, определяются числами пи /, линейный эффект Штарка отсутствует. [7]
Показать, что для атомов первой группы, у которых уровни энергии Е г определяются числами пи /, линейный эффект Штарка отсутствует. [8]
Напротив, если непосредственно связанный с ядром атом первой группы заряжен положительно ( разд. [9]
Опыты Штерна и Герлаха, проведенные с атомами первой группы периодической системы, получили простое объяснение после введения спина. [10]
Из табл. 1 следует, что электроотрицательности атомов 5 - 7-валентных элементов, как правило, больше, чем у атомов первых групп таблицы Менделеева. Поэтому примеси внедрения, образованные многовалентными атомами, являются обычно акцепторами. Наоборот, примеси внедрения, возникшие за счет введения в кристалл атомов 1 - 3-валентных элементов, в большинстве случаев являются донорными. Из этих рассуждений следует, что атомы одного и того же элемента могут быть как акцепторными, так и донорными примесями. Например атомы кислорода, заместившие в кристалле атомы кремния, выполняют роль доноров, а атомы кислорода, внедрившиеся в кристаллическую решетку кремния, являются акцепторами. [11]
Атомы первой группы затруднительно выявить при первоначальном изучении группы ионов, близких к молекулярному иону. Атомы второй группы обычно легко и быстро могут быть идентифицированы по масс-спектру. [12]
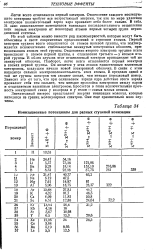 |
Ионизационные потенциалы для разных ступеней ионизации. [13] |
Из этой таблицы можно вывести ряд закономерностей, которые могут быть объяснены в свете современных представлений о строении атомов. Первый электрон труднее всего отщепляется от атомов нулевой группы, что подтверждается исключительно стабильностью замкнутых электронных оболочек, принадлежащих атомам этой группы. Отщепление второго электрона труднее всего происходит у атомов первой группы, а отщепление третьего - у атомов второй группы. В обоих случаях этот отщепляемый электрон принадлежит той же замкнутой оболочке. Наоборот, легче всего отщепляется первый электрон в атомах первой группы. Он является у этих атомов единственным валентным электроном, кладущим начало новой электронной оболочке. В связи с этим находится сильная электроположительность этих атомов. В пределах одной и той же группы электрон тем сильнее связан, чем меньше порядковый номер. Зависит это от того, что при одиншовом заряде ядра действие этого заряда проявляет себя тем сильнее, чем меньше прослойка электронов между ядром и отщепляемым валентным электроном. Бросается в глаза исключительная прочность электронной связи у водорода и у гелия - самых малых атомов. [14]
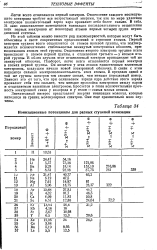 |
Ионизационные потенциалы для разных ступеней ионизации. [15] |
Страницы: 1 2