Двухвалентный атом
Cтраница 1
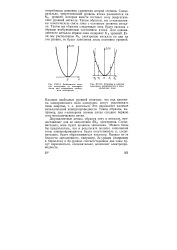 |
Зависимость энергии электронов от волнового числа для совершенно свободных электронов.| Разрывы в энергии. [1] |
Двухвалентные атомы, образуя зону в металле, предоставляют для ее заполнения 2ЯА электронов. Следовательно, зона будет целиком заполнена. [2]
Двухвалентный атом никеля имеет два непарных электрона нормальный момент, равный приблизительно трем магнетона Бора. [3]
Типичные двухвалентные атомы ( О, S, Mg, Ca, Cd) в свободном состоянии обладают четным числом электронов. Эти атомы весьма химически активны и входят в разнообразные реакции с валентно-насыщенными соединениями столь же легко, как и типичные одновалентные атомы. Энергия активации е реакции О Н2 - ОН Н равна приблизительно 6 ккал, в то время как для реакции Н Н3 - Н Н Н е 7 ккал. [4]
Типичные двухвалентные атомы ( О, S, Mg, Ca, Cd) в свобод ном состоянии обладают четным числом электронов. Эти атомы весьма химически активны и входят в разнообразные реакции с валентно-насыщенными соединениями столь же легко, как и типичные одновалентные атомы. Энергия активации е реакции 0 Н2 - ОН Н равна приблизительно 6 ккал, в то время как для реакции Н - НН2 - НН Н е 7 ккал. [5]
Число двухвалентных атомов на величину ФН не влияет. [6]
При добавлении других двухвалентных атомов ( РЬ, Са) наблюдается аналогичный эффект. [7]
Все одновалентные или двухвалентные атомы имеют плоскость симметрии и, следовательно, не могут быть причиной хи-ральности молекулы. Трехвалентные и четырехвалентные атомы с двумя, по крайней мере, идентичными заместителями также имеют плоскость симметрии. Только трехвалентные или четырехвалентные атомы, у которых все заместители отличаются друг от друга, не имеют плоскости симметрии и могут, но не обязательно, вызывать асимметрию молекулы как целого. Такой атом ( обычно атом углерода) называется асимметрическим атомом, и именно Он наиболее часто обусловливает хиральность молекулы, а следовательно, и оптическую активность. Вследствие этого иногда встречается неточный термин оптически активный атом. В принципе, заместители при асимметрическом атоме могут быть расположены двумя способами: правым или левым - в том смысле, как говорят о левоориентированной и правоориентированной спиралях. [8]
 |
Линейная форма молекулы НС1. [9] |
Таким образом, двухвалентный атом кислорода с двумя валентными р-электронами образует изогнутую ( угловую) молекулу воды. Очевидно, такие же изогнутые молекулы ( но с другой величиной угла) должны образовывать с водородом аналоги кислорода - сера, селен, теллур. [10]
Поскольку при внедрении двухвалентных атомов Mg или Ni расстояние между гидроксильными группами становится несколько больше, чем расстояние между атомами кислорода в основании слоя [ ( Si4O10) ( OH) 2ie -, To слои закручиваются так, как показано на рис. 22.16. При этом внутренний диаметр полученной трубки равен - 100 А, а внешний - 200 А. [11]
Поскольку при внедрении двухвалентных атомов Mg или Ni расстояние между гидроксильными группами становится несколько больше, чем расстояние между атомами кислорода в основании слоя [ ( Si4O10) ( OH) 3 ] 6 -, то слои закручиваются так, как показано на рис. 22.16. При этом внутренний диаметр полученной трубки равен л - 100 А, а внешний / - 200 А. [12]
Впоследствии радикалы с двухвалентным атомом азота удалось получить также и из некоторых триарилгидразпнов. [13]
Например, если какой-нибудь двухвалентный атом, скажем, атом цинка, находится в меди, то можно ожидать, что оба его валентных электрона объединятся с электронами проводимости меди, в результате чего образуется отдельный двухвалентный ион цинка с избыточным положительным зарядом, внедренный в решетку одновалентных ионов меди. [14]
Наличие в окиси углерода двухвалентного атома С - сближает ее с другими соединениями этого типа - с производными ацетилена и с синильной кислотой. Интересно, что способность образовывать соединения с гемоглобином наблюдается и у синильной кислоты, и у самого ацетилена) ( может быть за счет его изо-формы - см. спец. [15]
Страницы: 1 2 3 4