Кривая - конденсация
Cтраница 3
При температуре t2 процесс протекает следующим образом. При снижении давления в точке п начинается процесс конденсации, так как в этой точке изотерма t2 пересекает кривую конденсации. [31]
 |
Расчет ректификации бинарных. [32] |
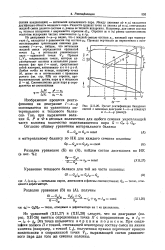
Из уравнений ( XII27) и (XII.28) следует, что на диаграмме ( см. рис. ХП-26) имеется определенная точка Я с координатами хр и 1П 1р дд - Эта точка называется верхним полюсом. При соеди-нейии полюса Я с точкой, отвечающей некоторому составу смеси на линии кипения ( например, сточкой LJ), полученная прямая пересекает кривую конденсации в сопряженной точке F1, выражающей состав равновесного пара для того же сечения колонны. [33]
Эта точка называется верхним полюсом. При соединении полюса П с точкой, отвечающей некоторому составу смеси на линии кипения ( например, с точкой Lt), полученная прямая пересекает кривую конденсации в сопряженной точке Vlt выражающей состав равновесного пара для того же сечения колонны. [34]
Из уравнений ( ХЦ, 22) и ( XII, 23) следует, что на диаграмме ( см. рис. XII-25) имеется определенная точка П с координатами хр и In ip 7д - Эта точка называется верхним полюсом. При соединении полюса П с точкой, отвечающей некоторому составу смеси на линии кипения ( например, с точкой L), полученная прямая пересекает кривую конденсации в сопряженной точке V, выражающей состав равновесного пара для того же сечения колонны. [35]
Сказанное можно проиллюстрировать графически. Кривая хКу на рис. 108, отвечающая смеси из 60 7 % изопентана и 39 3 % пропана, заключает в себе область, содержащую две фазы; справа - вниз от ветви уК, - пар, слева - вверх от ветви хК - жидкость. Кривая конденсации уК и кривая кипения хК смыкаются в критической точке К, в которой исчезает различие в свойствах обеих фаз. [36]
Кривая конденсации соответствует составу пара, а кривая кипения - составу жидкой фазы. Область на диаграмме, расположенная выше кривой конденсации, является областью пара, а ниже кривой кипения - областью жидкого состояния. Область, расположенная между кривыми конденсации и кипения, отвечает составу смеси, при котором не может существовать одна фаза - смесь распадается на жидкость и пар. Для реальных растворов на таких диаграммах всегда имеются обе кривые, однако их форма может заметно меняться. [37]
На диаграмму нанесены кривые конденсации 1 и кипения 2, а также изотермы. Выше кривой конденсации расположена область перегретого пара, между кривыми конденсации и кипения - область влажного пара, а ниже кривой кипения - область некипящей жидкости. Начало отсчета энтальпий в этой диаграмме сдвинуто для удобства выполнения графических построений при расчетах процесса ректификации. [38]
Диаграмма х - / системы кислород - азот для 1 3 ата изображена на фиг. На диаграмму нанесены кривые конденсации и кипения, а также изотермы. Выше кривой конденсации расположена область перегретого пара, между кривыми конденсации и кипения - область влажного пара, а ниже кривой кипения - область некипящей жидкости. [39]
В некоторых случаях диаграмма состояния смешивающихся во всех отношениях жидкостей имеет более сложный вид, как показано на фиг. Растворы, имеющие такую диаграмму состояния, называются неиде -, альными. В этом случае верхняя кривая ЛВС, изображающая состояние, насыщенного пара ( кривая конденсации), имеет экстремум ( например, максимум, как на фиг. [40]
На диаграмме кипения обычно показаны температуры. В системе координат с t в качестве ординаты и хв в качестве абсциссы наносим кривую кипения 1 и кривую конденсации 2, концы которых совпадают. На рис. 44 приведена диаграмма кипения смеси бензол-толуол. Для всех точек выше кривой конденсации 2 смесь находится полностью в парообразном состоянии. Для точек, расположенных между обеими кривыми, система состоит частично из жидкости и частично из пара, а ниже кривой кипения 1 находится только жидкость. Диаграмма кипения экспериментально определяется так же, как и кривая равновесия ( см. главу 4.63); аналогичным путем ее можно использовать для определения необходимого количества теоретических тарелок. На рис. 45 приведена кривая равновесия смеси бензол-толуол, полученная на основании диаграммы кипения. Точки А и В расположены теперь одна над другой. [41]
Пусть требуется подвергнуть постепенной конденсации насыщенный пар состава а, фигуративная точка 1 / 2 которого расположена на кривой СЕ равновесных составов паровой фазы. С этим паром находится в равновесии микроскопическая капля жидкости, фигуративная точка R2 которой расположена в точке пересечения изотермы начала конденсации с кривой точек кипения жидкой фазы. Непрерывное понижение температуры начального пара 1 / 2 сопровождается его постепенной конденсацией и отводом конденсата, в результате чего фигуративная точка остаточного пара, обогащающегося в ходе конденсации низкокипящим компонентом а, будет все время двигаться вдоль кривой СЕ конденсации от точки 1 / 2 вниз, по направлению к фигуративной точке С чистого компонента а. [42]
На диаграмме t - X, Y нижняя ветвь является кривой кипе - ния, под ней расположена область жидкой фазы. Верхняя ветвь диаграммы является кривой конденсации, над ней расположена область перегретого пара. Пересечение данной изотермы с кривыми конденсации и кипения определяет состав равновесных фаз. Соотношение между количествами этих фаз определяется по правилу рычага. Так, если дана исходная жидкость состава X при температуре tu, то после нагрева ее до температуры t она начнет кипеть. [43]
Резервуар нагревается при постоянном давлении в нем. Этот пар содержится в более летучем компоненте. Геометрическое место одних из них образует линию AXZRB, которая известна как кривая парообразования или кипения. Геометрическое место точек, таких как S, образует линию AWVSB, известную как кривая конденсации. [44]
Страницы: 1 2 3