Кривая - возгонка
Cтраница 1
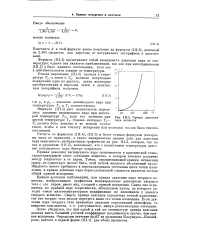 |
Кривая давления пара жидкости. [1] |
Кривая возгонки ( сублимации), или кривая давления пара твердого вещества, изображающая графически моновариантное равновесие твердого тела с его паром, имеет вид, сходный с кривой испарения. Снизу она ограничена, по крайней мере теоретически, абсолютным нулем, до которого доходит самая низкотемпературная модификация из имеющихся у данного твердого вещества. Сверху кривая возгонки ограничена точкой плавления, так как твердое тело нельзя перегреть выше его точки плавления. [2]
Кривая возгонки МО отражает зависимость давления насыщенного пара над кристаллами. Все три кривые - испарения ( ОК), плавления ( OL) и возгонки ( ОМ) - сходятся в тройной точке, единственной ( согласно правилу фаз), в которой могут существовать три фазы: твердая, жидкая и газообразная. [3]
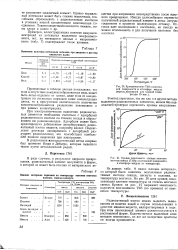 |
Кривые зависимости степени возгонки. [4] |
Кривая возгонки ThB с платиновой поверхности в атмосфере воздуха ( период нагревания для каждой температуры 15 мин. [5]
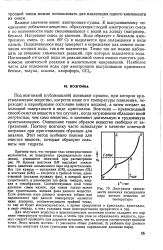 |
Диаграмма зависимости давления насыщенного пара чистого вещества от температуры. [6] |
Кривая возгонки ОМ выражает зависимость давления насыщенного пара над кристаллами. Все три кривые - испарения ( О / С), плавления ( OL) и возгонки ( ОМ) - сходятся в тройной точке, единственной ( согласно правилу фаз), в которой могут существовать в равновесии три фазы: твердая, жидкая и газообразная. Соответствующее этой точке давление самое низкое, при каком только может еще существовать жидкая фаза данного вещества. [7]
Следовательно, кривая возгонки идет круче, чем кривая испарения. Эти кривые пересекаются в точке плавления, так как в этой точке давление пара твердой фазы равно давлению пара жидкой фазы. [8]
Поэтому п точке о кривая возгонки всегда поднимается круче кривой кипения. [9]
Следует отметить, что кривую возгонки оЪ нельзя продолжить правее точки о, так как перегретые кристаллы получить невозможно. При температуре Т колебание молекул, образующих кристалл, достигает такой амплитуды, что решетка распадается п кристалл плавится. [10]
Двухфазные равновесия на диаграмме состояния характеризуются кривыми возгонки ( или сублимации), кипения и плавления. [11]
Диаграмма состояния одно-компонентной системы: 1 - кривая возгонки, 2-кривая плавления, 3-кривая испа ренвя; Л - тройная точка, К-критич. [12]
Полезно отметить, что вблизи тройной точки кривая возгонки всегда обладает более крутым подъемом, чем кривая кипения, так как теплота возгонки больше теплоты кипения. [13]
Полезно отметить, что вблизи тройной точки кривая возгонки всегда обладает более крутым подъемом, чем кривая кипения, так как теплота возгонки больше теплоты кипения. [14]
 |
Объемная диаграмма состояния воды при относительно небольших давлениях. [15] |
Страницы: 1 2 3