Вольт-амперная кривая
Cтраница 3
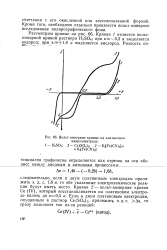
Какой вид имеет вольт-амперная кривая в присутствии нескольких восстанавливающихся ионов. [31]
 |
Схема визуального полярографа и электролитической ячейки. [32] |
Полученная каким-либо способом вольт-амперная кривая ( полярографическая волна) характеризует концентрацию и природу восстанавливающегося на катоде вещества. Высота волны ( предельный диффузионный ток) прямо пропорциональна концентрации восстанавливающегося вещества. Потенциал, при котором ток достигает половины предельного значения ( потенциал полуволны ei / 2 является величиной постоянной для данного исследуемого восстанавливающегося вещества, его качественной характеристикой, не зависящей от концентрации. [33]
Предназначен для регистрации вольт-амперных кривых ( по-лярограмм) в классическом и переменнотоковом режимах. В комплект полярографа входит: прибор, регистратор, стабилизатор напряжения, полярографический датчик и эквивалент электролитической ячейки. [34]
Выражения для формы вольт-амперных кривых в случае линейно изменяющегося потенциала при линейной диффузии были впервые выведены независимо друг от друга Рэндлсом [45] и Шевчиком [46] - для процессов с обратимой электрохимической стадией и Делахеем [47] - для случая необратимых электрохимических реакций. Эти кривые имеют характерную горбообразную форму с более или менее крутым подъемом до максимума и пологим спуском после максимума. Такой характер кривых объясняется следующим. В начале электролиза, когда потенциал электрода очень мал, скорость электрохимической реакции очень низка ( предполагается, что в растворе присутствует лишь один компонент окислительно-восстановительной системы), так что ток через электролизер практически не протекает. По мере увеличения потенциала возрастает скорость электрохимической реакции и увеличивается ток. [35]
Такой характер поведения вольт-амперных кривых при переходе от расплава КС1 - KF - K2NbF7 к установлению равновесия этого расплава с металлическим ниобием объясняется следующим образом. [36]
 |
Вольт-амперные кривые на платиновом. [37] |
Кривая / является вольт-амперной кривой раствора H2SO4; при е - 0 2 в выделяется водород; при 84 - 1 4 в выделяется кислород. [38]
Дуговой разряд характеризуется падающей вольт-амперной кривой, а также наличием плазмы и катодного пятна. Электроны, необходимые для поддержания разряда, поступают с катода в основном за счет термоэлектронной эмиссии. [39]
Приведенные на рис. 25 вольт-амперные кривые были получены при постепенном изменении потенциала индикаторного электрода от положительных к отрицательным значениям. Если же эти кривые снимать в обратном направлении, то ( подобно тому, как было описано в гл. II для ртути) при потенциалах несколько менее положительных, чем потенциал восстановления ионов меди ( II) [ серебра или золота ( III) ], будет наблюдаться анодный пик окисления металлической меди ( серебра или золота), которая выделилась на электроде во время полярографирования. [40]
На рис. 46 приведены вольт-амперные кривые для восстановления ионов серебра, меди, таллия и свинца на фоне 0 1 М растворов КС1 и KNO3, полученные Кольтгофом [4] с использованием стационарного платинового Электрода. Характерной особенностью этих кривых является различие в потенциалах выделения водорода. Это объясняется тем, что выделение водорода зависит от его перенапряжения на металле, который осаждается в процессе электролиза на поверхности платины. Поэтому при восстановлении ионов серебра водород выделяется несколько раньше, чем при восстановлении ионов свинца или меди. [41]
 |
Вольт-амперные кривые. [42] |
В ряде случаев получаемые вольт-амперные кривые не совпадают с теоретическими кривыми для данной электрохимической реакции. [43]
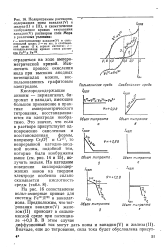 |
Подпрограммы растворов, содержащих ионы ванадия ( V и железа ( II и III, и схематическое изображение кривых титрования ванадия ( V раствором соли Мора в различных условиях. [44] |
На рис. 16 сопоставлены вольт-амперные кривые для системы РеП1 / Рп и ванадат-иона. Предположим, что тит - рования ванадия ( V) железом ( II) проводят в сильнокислой среде при потенциале 0 3 В. [45]
Страницы: 1 2 3 4 5