Кристалл - затравка
Cтраница 1
Кристаллы затравки не должны быть меньше определенных для данного вещества и температуры размеров, так как очень мелкие частицы могут оказаться термодинамически неустойчивыми, и будут растворяться, увеличивая пересыщение раствора. Для получения относительно крупных кристаллов число затравочных кристаллов не должно быть слишком большим. [1]
Наилучшим направлением ориентации кристалла затравки является, невидимому, направление ( 111) ( см. гл. [2]
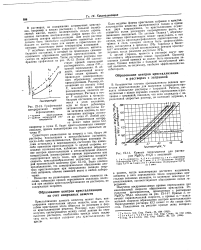 |
Кривые пересыщения для растворов MgSO - 7H2O с затравкой. [3] |
Если подобие формы кристаллов затравки и кристаллизующегося вещества выдерживается только в одном или двух направлениях, то кристаллизация осуществляется путем усиленного направленного роста, называемого эпитаксией. [4]
Из результатов работ [66, 69, 71] неясно, каковы скорости роста кристаллов затравки и зародышей, вновь образующихся в самом процессе кристаллизации. [5]
Скорость кристаллизации dyjdt согласно уравнениям (3.2.12) и (3.2.15) зависит от распределения кристаллов затравки по размерам. Однако если в систему введено мало кристаллов, то объем каждого из них увеличивается настолько, что различия их начального размера становятся несущественными. [6]
Данные для образцов 1, 2 и 3 из табл. 1.4. Средний радиус кристаллов затравки r0 0 23 мкм; точки - экспериментальные данные; сплошные линии - расчетные кривые. [8]
Для понимания роли жидкой фазы гелей в процессе их кристаллизации важным является наблюдающийся рост кристаллов затравки, вводимых в гели. При этом, как показали наши опыты с цеолитом А, линейные скорости роста кристаллов затравки и вновь образующихся кристаллов оказываются близкими. Это указывает на то, что и те и другие кристаллы растут за счет компонентов общего для них раствора. [9]
Из рассматриваемого механизма образования и роста кристаллов цеолитов в силикаалюмогелях и данных рис. 1.13 следует, что кристаллы затравки, вводимые в гели, должны расти с той же скоростью, что и вновь образующиеся в геле кристаллы. Это обстоятельство было отмечено в [62] и позднее экспериментально подтверждено в других исследованиях авторов этой книги. [10]
Следует подчеркнуть, что и характер кристаллизации в присутствии затравки может определяться степенью гидратации ионов, присоединяющихся к кристаллам затравки. [11]
Приведенные данные по вторичному зародышеобразованию в растворах различных солей интересны прежде всего с точки зрения оценки значимости того или иного механизма зарождения новой фазы в присутствии кристаллов затравки. Судя по приведенным данным, они далеко не равнозначны. Очень большое число вторичных зародышей образуется за счет содержащихся на поверхности кристаллов мельчайших частиц твердой фазы. При том же переохлаждении вчрезультате прямых соударений образуется около 500 зародышей сульфата магния за 1 мин. Сравнивая эти цифры, видим, что в момент введения примеси происходит интенсивное зародышеобразование. Из механизмов контактного зародышеобразования наиболее эффективными представляются соударения при перемешивании. [12]
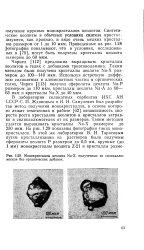 |
Монокристаллы. цеолита Na-X, полученные из силикаалю-могеля без органических добавок. [13] |
В лаборатории силикатных сорбентов ИХС АН СССР С. П. Ждановым и Н. Н. Самулевич был разработан метод получения монокристаллов, в основе которого лежит отмеченная в работе [62] независимость скорости роста кристаллов цеолитов и кристаллов затравки в силикаалюмогелях от их размеров. Таким методом удается выращивать кристаллы Na-X размером до 250 мкм. На рис. 1.29 показаны фотографии таких монокристаллов. [14]
Начальную стадию кристаллизации можно значительно ускорить искусственным введением в раствор зародышей малых частиц кристаллизующегося вещества, так называемой затравки. Кристаллы затравки не должны быть меньше определенных для данного вещества и температуры размеров, так как очень мелкие частицы могут оказаться термодинамически неустойчивыми и будут растворяться, увеличивая пересыщение раствора. Для получения относительно крупных кристаллов число затравочных кристаллов не должно быть слишком большим. [15]
Страницы: 1 2 3
